
【題目】B、N、Ti、Fe都是重要的材料元素,其單質及化合物在諸多領域中都有廣泛的應用。
(1)基態(tài)Fe2+的電子排布式為_____;Ti原子核外共有________種運動狀態(tài)不同的電子。
(2)BH3分子與NH3分子的空間結構分別為_________;BH3與NH3反應生成的BH3·NH3分子中含有的化學鍵類型有_______,在BH3·NH3中B原子的雜化方式為________。
(3)N和P同主族。科學家目前合成了N4分子,該分子中N—N—N鍵的鍵角為________;N4分解后能產生N2并釋放出大量能量,推測其用途___________。(寫出一種即可)
(4)NH3與Cu2+可形成[Cu(NH3)4]2+配離子。已知NF3與NH3具有相同的空間構型,但NF3不易與Cu2+形成配離子,其原因是____。
(5)納米TiO2是一種應用廣泛的催化劑,其催化的一個實例如圖所示。化合物乙的沸點明顯高于化合物甲,主要原因是______。化合物乙中采取sp3雜化的原子的第一電離能由大到小的順序為________。
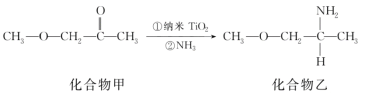
【答案】1s2 2s2 2p6 3s2 3p6 3d6 或[Ar]3d6 22 平面正三角形、三角錐形 共價鍵、配位鍵 sp3 60° 制造火箭推進劑或炸藥(其他合理答案均可) F 的電負性比 N 大,N—F 成鍵電子對偏向 F,導致 NF3 中氮原子核對其孤電子對的吸引能力增強,難以形成配位鍵 化合物乙分子間存在氫鍵 N>O>C
【解析】
(1)鐵為26號元素,原子失去最外層4s能級2個電子,形成Fe2+,據(jù)此書寫核外電子排布式,核外的每個電子的運動狀態(tài)均不同;
(2)NH3分子中氮原子含有孤電子對,BF3分子中B元素不含孤電子對,導致其空間構型不同;根據(jù)價層電子對互斥理論確定BF3的分子空間構型;
(3)N4分子與P4結構相似,為正四面體構型,每個面均為正三角形;N4分解后能產生N2并釋放出大量能量,據(jù)此判斷用途;
(4)NF3中N-F成鍵電子對偏向于F原子,N原子上的孤對電子難與銅離子形成配離子;
(5)氫鍵的存在導致物質熔沸點升高;化合物乙中能形成sp3雜化的原子有C、N、O元素,同一周期元素,元素第一電離能隨著原子序數(shù)增大而呈增大趨勢,但第IIA族、第VA族元素第一電離能大于其相鄰元素,據(jù)此排序。
(1)鐵原子失去最外層4s能級2個電子,形成Fe2+,核外電子排布式為:1s22s22p63s23p63d6或[Ar]3d6;Ti元素原子核外有22個電子,所以原子中運動狀態(tài)不同的電子共有22種,故答案為:1s22s22p63s23p63d6或[Ar]3d6;22;
(2)NH3分子中氮原子含有孤電子對,BF3分子中B元素不含孤電子對,BF3中B原子含有3個σ鍵且不含孤電子對,所以BF3為平面三角形構型,NH3中N原子含有3個σ鍵和1個孤電子對,所以NH3為三角錐構型;BF3NH3分子中含有的化學鍵類型有共價鍵、配位鍵;在BF3NH3中B原子的價層電子對數(shù)為4+0=4,雜化方式為sp3,故答案為:平面正三角形;三角錐型;共價鍵、配位鍵;sp3;
(3)N4分子中N原子形成3個σ鍵、含有1對孤對電子,雜化軌道數(shù)目為4,N原子采取sp3雜化,每個面為正三角形,N-N 鍵的鍵角為60°;N4分解后能產生N2并釋放出大量能量,可以制造火箭推進劑或炸藥,故答案為:60°;制造火箭推進劑或炸藥;
(4)F的電負性大于N元素,NF3中N-F成鍵電子對偏向于F原子,導致NF3中氮原子核對其孤電子對的吸引能力增強,N原子上的孤對電子難與銅離子形成配離子,所以NF3不易與Cu2+形成配離子,故答案為:F的電負性比N大,N-F成鍵電子對偏向F,導致NF3中氮原子核對其孤電子對的吸引能力增強,難以形成配位鍵;
(5)氫鍵的存在會導致物質熔沸點升高,乙中含有分子間氫鍵、甲不含氫鍵,所以化合物乙熔沸點高于甲;化合物乙中能形成sp3雜化的原子有C、N、O元素,同一周期元素,元素第一電離能隨著原子序數(shù)增大而呈增大趨勢,但第IIA族、第VA族元素第一電離能大于其相鄰元素,所以第一電離能N>O>C,故答案為:化合物乙分子間存在氫鍵;N>O>C。


 新思維假期作業(yè)暑假吉林大學出版社系列答案
新思維假期作業(yè)暑假吉林大學出版社系列答案 藍天教育暑假優(yōu)化學習系列答案
藍天教育暑假優(yōu)化學習系列答案科目:高中化學 來源: 題型:
【題目】NA代表阿伏加德羅常數(shù)的值。下列說法正確的是
A. 常溫常壓下,124 g P4中所含P—P鍵數(shù)目為4NA
B. 100 mL 1mol·L1FeCl3溶液中所含Fe3+的數(shù)目為0.1NA
C. 標準狀況下,11.2 L甲烷和乙烯混合物中含氫原子數(shù)目為2NA
D. 密閉容器中,2 mol SO2和1 mol O2催化反應后分子總數(shù)為2NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度時,在2 L的密閉容器中,X、Y、Z 三種物質的物質的量隨時間的變化曲線如圖所示。
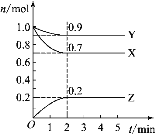
(1)由圖中數(shù)據(jù)分析,該反應的化學方程式_____________。
(2)從反應開始至2 min,Z的平均反應速率為________。
(3)第5 min時,Z的生成速率________(填“大于”“小于”或“等于”)Z的消耗速率。
(4)第_______分鐘時,反應達到平衡。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氨是合成硝酸、銨鹽和氮肥的基本原料,回答下列問題:
(1)NH3的電子式______。
(2)氯化銨水溶液顯酸性,其原因為______(用離子方程式表示),0.1mol/L的氨水中加入少量的NH4Cl固體,溶液的pH______(填“升高”或“降低”);若加入少量的明礬固體后,請嘗試從平衡移動的角度解釋溶液中NH4+濃度的變化原因______。
(3)硝酸銨加熱分解可得到N2O(g)和H2O(g),250℃時,硝酸銨在密閉容器中分解達到平衡,該溫度下反應的平衡常數(shù)表達式為______;若有1mol硝酸銨完全分解,轉移的電子數(shù)為______mol。
(4)3H2(g)+N2(g)2NH3(g)△H=-92kJ/mol,若反應放出9.2kJ 熱量,則參加反應的氫氣分子數(shù)目為______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為減小CO2對環(huán)境的影響,在限制其排放量的同時,應加強對CO2創(chuàng)新利用的研究。
(1)①把含有較高濃度CO2的空氣通入飽和K2CO3溶液。②在①的吸收液中通高溫水蒸氣得到高濃度的CO2氣體。請寫出②中反應的化學方程式______。
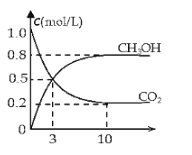
(2)如將CO2與H2以1:3的體積比混合,在適當條件下合成燃料甲醇和水。在體積為2L的密閉容器中,充入2mol CO2和6mol H2,一定條件下發(fā)生反應:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=-49.0kJ/mol。測得CO2(g)和CH3OH(g)的濃度隨時間變化如圖所示。
從反應開始到平衡,v(H2)=______;氫氣的轉化率=______;能使平衡體系中n(CH3OH)增大的措施有______。(只寫一種即可)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現(xiàn)有常溫下甲、乙、丙三種溶液,甲為0.1 mol·L-1的NaOH溶液,乙為0.1 mol·L-1的HCl溶液,丙為0.1 mol·L-1的CH3COOH溶液,試回答下列問題:
(1)甲溶液的pH=________。
(2)丙溶液中存在的電離平衡為______________(用電離平衡方程式表示)。
(3)常溫下,用水稀釋0.1 mol·L-1的CH3COOH溶液時,下列各量隨水量的增加而增大的是________(填序號)。
①n(H+) ②c(H+) ③ c(CH3COOH)/c(CH3COO-) ④c(OH-)
(4)甲、乙、丙三種溶液中由水電離出的c(OH-)的大小關系為___________。
(5)某同學用甲溶液分別滴定20.00 mL乙溶液和20.00 mL丙溶液,得到如圖所示的兩條滴定曲線,請回答有關問題:
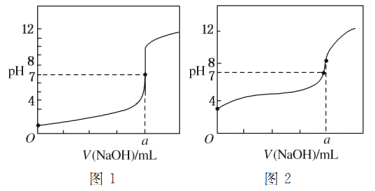
①甲溶液滴定丙溶液的曲線是________(填“圖1”或“圖2”)曲線。
②a=________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A.  與
與![]() 含有相同的官能團,互為同系物
含有相同的官能團,互為同系物
B. 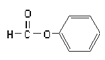 屬于醛類,官能團為-CHO
屬于醛類,官能團為-CHO
C. ![]() 的名稱為:2-乙基-1-丁烯
的名稱為:2-乙基-1-丁烯
D. ![]() 的名稱為:2-甲基-1,3-二丁烯
的名稱為:2-甲基-1,3-二丁烯
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙醇是重要的有機化工原料,也是優(yōu)質的燃料,工業(yè)上可由乙烯水合法或發(fā)酵法生產。回答下列問題:
(1)乙烯水合法可分為兩步
第一步:反應CH2=CH2+ HOSO3H(濃硫酸)→CH3CH2OSO3H(硫酸氫乙酯);
第二步:硫酸氫乙酯水解生成乙醇。
①第一步屬于反應_______________(填反應類型)。
②第二步反應的化學方程式為_____________________________。
(2)發(fā)酵法制乙醇,植物秸稈(含50%纖維素)為原料經(jīng)以下轉化制得乙醇

纖維素的化學式為________,現(xiàn)要制取4.6 噸乙醇,至少需要植物秸稈________噸。
(3)乙醇汽油是用90%的普通汽油與10%的燃料乙醇調和而成。乙醇汽油中乙醇是可再生能源,來源于________(填“乙烯水合法”或“發(fā)酵法”)。
(4)以乙醇為原料可制備某種高分子涂料,其轉化關系如下圖:

①有機物A的結構簡式為___________。
②反應Ⅱ的化學方程式為___________。
③反應Ⅱ的反應類型為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以廢舊鋰離子電池的正極材料(主要含LiCoO2、Al、C等)為原料制備CoC2O4.2H2O的一種實驗流程如圖:
![]()
![]()
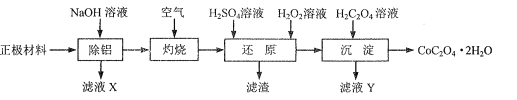
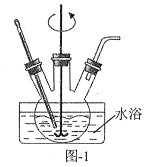
(1)“除鋁”可在如圖1所示的裝置中進行。保持溫度、反應物和溶劑的量不變,實驗中提高鋁的去除率的措施有___。
(2)“灼燒”的主要目的是___。
(3)“還原”步驟溫度在70℃左右,LiCoO2發(fā)生反應的化學方程式為___。若該步驟用鹽酸代替H2SO4和H2O2,也可達到“還原”的目的,但其缺點是___。
(4)“沉淀”步驟中,證明Co2+已沉淀完全的實驗操作及現(xiàn)象是___。
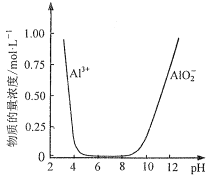
(5)設計由“濾液X”制備純凈的Al2O3的實驗方案。(已知含鋁物種濃度與pH的關系如圖所示。實驗中必須使用的試劑:H2SO4溶液、BaCl2溶液、蒸餾水)___。
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com