
除去下列各物質中的少量雜質,括號內的試劑和操作正確的是
A.丙烷中的丙烯(H2 加熱) B.乙醇中的水(無水CuSO4,蒸餾)
C.苯中的二甲苯(Br2水,分液) D.甲苯中的苯酚(NaOH溶液,分液)
 品學雙優卷系列答案
品學雙優卷系列答案 小學期末沖刺100分系列答案
小學期末沖刺100分系列答案 期末復習檢測系列答案
期末復習檢測系列答案 超能學典單元期中期末專題沖刺100分系列答案
超能學典單元期中期末專題沖刺100分系列答案 黃岡360度定制密卷系列答案
黃岡360度定制密卷系列答案科目:高中化學 來源: 題型:
(1)在焚燒爐的床料中加入__________可實現焚燒過程中產生的SOx在爐內除去。寫出有關的反應方程式:_________________________________________________________________。
(2)在吸收塔內加入__________廉價吸收劑可除去煙氣中的HCl,化學方程式為___________
____________________________________________________________________。
(3)二![]() 英主要是垃圾中存在的無機氯化物和有機氯化物在過渡金屬(如Cu2+)催化作用下不完全燃燒形成的。以上操作中向焚燒爐內不斷噴氨,其目的是________________________
英主要是垃圾中存在的無機氯化物和有機氯化物在過渡金屬(如Cu2+)催化作用下不完全燃燒形成的。以上操作中向焚燒爐內不斷噴氨,其目的是________________________
____________________________________________________________________。
(4)為了減少垃圾焚燒過程產生二![]() 英,可用裝有固體的吸收塔吸收,該固體吸收劑是__________,它具有__________性。
英,可用裝有固體的吸收塔吸收,該固體吸收劑是__________,它具有__________性。
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
Ⅰ)純凈的過氧化鈣(CaO2)難溶于水、乙醇,常溫下較為穩定。CaO2·8H2O在0℃時穩定,加熱至130℃時逐漸變為無水CaO2。在實驗室可用鈣鹽制取CaO2·8H2O,再經脫水制得CaO2。其制備過程如下:
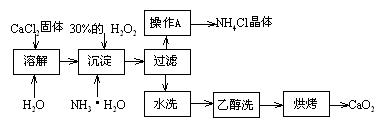
根據以上信息,回答下列問題:
⑴用上述方法制取CaO2·8H2O的化學方程式是_▲_;
⑵測定產品中CaO2的含量的實驗步驟是(己知:I2+2S2O32-=2I-+S4O62-):
第一步:準確稱取ag產品于錐形瓶中,加入適量蒸餾水和過量的bgKI品體,再滴入適量2mol·L-1的H2SO4溶液,充分反應:
第二步:向上述錐形瓶中加入幾滴淀粉溶液:
第三步:逐滴加入濃度為cmol·L-1的Na2S2O3溶液至反應完全,消耗Na2S2O3溶液VmL。
①第三步反應完全時的現象為 ▲ ;
②產品中CaO2的質量分數為 ▲ (用字母表示);
③某同學經實驗測得產品中CaO2的質量分數偏高,造成偏高的原因是(測定過程中由操作產生的誤差忽略不計,用離子方程式表示) ▲ 。
Ⅱ)硫酸銅是一種重要的化工原料,工業上常用硫酸為原料來制備硫酸銅。
⑴工業上生產硫酸過程中,焙燒硫鐵礦時產生的廢渣是一種二次資源。
①為了從廢渣中磁選獲得品位合格的鐵精礦,高溫下利用CO使弱磁性Fe2O3轉化為強磁性Fe3O4。寫出該反應的化學方程式_ ▲ _;實驗發現:CO太多或太少都會導致磁鐵礦產率降低,原因是 ▲ 。
②氯化焙燒工藝是將廢渣用氯化鈣水溶液調和、成球、高溫焙燒,廢渣中SiO2與CaCl2等在高溫下反應放出HCl,HCl與金屬氧化物等反應生成氯化物。反應生成的各金屬氯化物以氣態形式逸出,進而回收有色金屬和回返氯化鈣溶液。寫出氯化焙燒工藝中生成HCl的化學方程式 ▲ 。
⑵測定硫酸銅品體中結品水含量的實驗步驟為:
步驟1:準確稱量一個潔凈、干燥的坩堝;
步驟2:將一定量的硫酸銅晶體試樣研細后,放入坩堝中稱重
步驟3:將盛有試樣的坩堝加熱,待晶體變成白色粉末時,停止加熱;
步驟4:將步驟3中的坩堝放入干燥器,冷卻至室溫后,稱重:
步驟5: ▲ ;
步驟6:根據實驗數據計算硫酸銅晶體試樣中結晶水的質量分數。
請完成實驗步驟5。
(3)已知硫酸銅晶體受熱可以逐步失去結晶水,溫度升高還可以分解生成銅的氧化物。取25.0gCuSO4·5H2O晶體均勻受熱,緩慢升溫至1200℃并恒溫1小時,實驗測得固體殘留率(剩余固體的質量/原始固體質量)與溫度的關系如下圖所示:
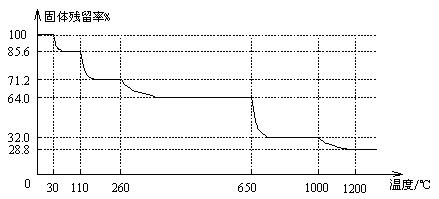
在110℃時所得固體的成分為 ▲ ;在1200℃并恒溫1小時,反應所得氣態產物除去水后,物質的量為 ▲ 。(填字母)
A.0mol B.0.1mol C.0.125mol D.大于0.125mol
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
Ⅰ)純凈的過氧化鈣(CaO2)難溶于水、乙醇,常溫下較為穩定。CaO2·8H2O在0℃時穩定,加熱至130℃時逐漸變為無水CaO2。在實驗室可用鈣鹽制取CaO2·8H2O,再經脫水制得CaO2。其制備過程如下:
根據以上信息,回答下列問題:
⑴用上述方法制取CaO2·8H2O的化學方程式是_▲_;
⑵測定產品中CaO2的含量的實驗步驟是(己知:I2+2S2O32-=2I-+S4O62-):
第一步:準確稱取ag產品于錐形瓶中,加入適量蒸餾水和過量的bgKI品體,再滴入適量2mol·L-1的H2SO4溶液,充分反應:
第二步:向上述錐形瓶中加入幾滴淀粉溶液:
第三步:逐滴加入濃度為cmol·L-1的Na2S2O3溶液至反應完全,消耗Na2S2O3溶液VmL。
①第三步反應完全時的現象為 ▲ ;
②產品中CaO2的質量分數為 ▲ (用字母表示);
③某同學經實驗測得產品中CaO2的質量分數偏高,造成偏高的原因是(測定過程中由操作產生的誤差忽略不計,用離子方程式表示) ▲ 。
Ⅱ)硫酸銅是一種重要的化工原料,工業上常用硫酸為原料來制備硫酸銅。
⑴工業上生產硫酸過程中,焙燒硫鐵礦時產生的廢渣是一種二次資源。
①為了從廢渣中磁選獲得品位合格的鐵精礦,高溫下利用CO使弱磁性Fe2O3轉化為強磁性Fe3O4。寫出該反應的化學方程式_ ▲ _;實驗發現:CO太多或太少都會導致磁鐵礦產率降低,原因是 ▲ 。
②氯化焙燒工藝是將廢渣用氯化鈣水溶液調和、成球、高溫焙燒,廢渣中SiO2與CaCl2等在高溫下反應放出HCl,HCl與金屬氧化物等反應生成氯化物。反應生成的各金屬氯化物以氣態形式逸出,進而回收有色金屬和回返氯化鈣溶液。寫出氯化焙燒工藝中生成HCl的化學方程式 ▲ 。
⑵測定硫酸銅品體中結品水含量的實驗步驟為:
步驟1:準確稱量一個潔凈、干燥的坩堝;
步驟2:將一定量的硫酸銅晶體試樣研細后,放入坩堝中稱重
步驟3:將盛有試樣的坩堝加熱,待晶體變成白色粉末時,停止加熱;
步驟4:將步驟3中的坩堝放入干燥器,冷卻至室溫后,稱重:
步驟5: ▲ ;
步驟6:根據實驗數據計算硫酸銅晶體試樣中結晶水的質量分數。
請完成實驗步驟5。
(3)已知硫酸銅晶體受熱可以逐步失去結晶水,溫度升高還可以分解生成銅的氧化物。取25.0gCuSO4·5H2O晶體均勻受熱,緩慢升溫至1200℃并恒溫1小時,實驗測得固體殘留率(剩余固體的質量/原始固體質量)與溫度的關系如下圖所示:
在110℃時所得固體的成分為 ▲ ;在1200℃并恒溫1小時,反應所得氣態產物除去水后,物質的量為 ▲ 。(填字母)
A.0mol B.0.1mol C.0.125mol D.大于0.125mol
查看答案和解析>>
科目:高中化學 來源:2010-2011學年四川省成都市高三第二次診斷性考試模擬試卷(理綜)化學部分 題型:實驗題
Ⅰ)純凈的過氧化鈣(CaO2)難溶于水、乙醇,常溫下較為穩定。CaO2·8H2O在0℃時穩定,加熱至130℃時逐漸變為無水CaO2。在實驗室可用鈣鹽制取CaO2·8H2O,再經脫水制得CaO2。其制備過程如下:

根據以上信息,回答下列問題:
⑴用上述方法制取CaO2·8H2O的化學方程式是_▲_;
⑵測定產品中CaO2的含量的實驗步驟是(己知:I2+2S2O32-=2I-+S4O62-):
第一步:準確稱取ag產品于錐形瓶中,加入適量蒸餾水和過量的bgKI品體,再滴入適量2mol·L-1的H2SO4溶液,充分反應:
第二步:向上述錐形瓶中加入幾滴淀粉溶液:
第三步:逐滴加入濃度為cmol·L-1的Na2S2O3溶液至反應完全,消耗Na2S2O3溶液VmL。
①第三步反應完全時的現象為 ▲ ;
②產品中CaO2的質量分數為 ▲ (用字母表示);
③某同學經實驗測得產品中CaO2的質量分數偏高,造成偏高的原因是(測定過程中由操作產生的誤差忽略不計,用離子方程式表示) ▲ 。
Ⅱ)硫酸銅是一種重要的化工原料,工業上常用硫酸為原料來制備硫酸銅。
⑴工業上生產硫酸過程中,焙燒硫鐵礦時產生的廢渣是一種二次資源。
①為了從廢渣中磁選獲得品位合格的鐵精礦,高溫下利用CO使弱磁性Fe2O3轉化為強磁性Fe3O4。寫出該反應的化學方程式_ ▲ _;實驗發現:CO太多或太少都會導致磁鐵礦產率降低,原因是 ▲ 。
②氯化焙燒工藝是將廢渣用氯化鈣水溶液調和、成球、高溫焙燒,廢渣中SiO2與CaCl2等在高溫下反應放出HCl,HCl與金屬氧化物等反應生成氯化物。反應生成的各金屬氯化物以氣態形式逸出,進而回收有色金屬和回返氯化鈣溶液。寫出氯化焙燒工藝中生成HCl的化學方程式 ▲ 。
⑵測定硫酸銅品體中結品水含量的實驗步驟為:
步驟1:準確稱量一個潔凈、干燥的坩堝;
步驟2:將一定量的硫酸銅晶體試樣研細后,放入坩堝中稱重
步驟3:將盛有試樣的坩堝加熱,待晶體變成白色粉末時,停止加熱;
步驟4:將步驟3中的坩堝放入干燥器,冷卻至室溫后,稱重:
步驟5: ▲ ;
步驟6:根據實驗數據計算硫酸銅晶體試樣中結晶水的質量分數。
請完成實驗步驟5。
(3)已知硫酸銅晶體受熱可以逐步失去結晶水,溫度升高還可以分解生成銅的氧化物。取25.0gCuSO4·5H2O晶體均勻受熱,緩慢升溫至1200℃并恒溫1小時,實驗測得固體殘留率(剩余固體的質量/原始固體質量)與溫度的關系如下圖所示:

在110℃時所得固體的成分為 ▲ ;在1200℃并恒溫1小時,反應所得氣態產物除去水后,物質的量為 ▲ 。(填字母)
A.0mol B.0.1mol C.0.125mol D.大于0.125mol
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com