
氫化鈣(CaH2)固體是登山運動員常用的能源提供劑。氫化鈣要密封保存,一旦接觸到水就發生反應生成氫氧化鈣和氫氣。氫化鈣通常用氫氣與金屬鈣加熱制取,圖1是模擬制取裝置:
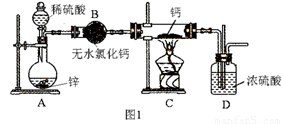
(1)裝置B的作用是 ;裝置D的作用是 ;
(2)利用圖1實驗裝置進行實驗,實驗步驟如下:檢查裝置氣密性后裝入藥品;打開分液漏斗活塞, (請按正確的順序填入下列步驟的序號)。
①加熱反應一段時間 ②收集氣體并檢驗其純度
③關閉分液漏斗活塞 ④停止加熱,充分冷卻
(3)為了確認進入裝置C的氫氣已經干燥,應在B、C之間再接一裝置,該裝置中加入的試劑是: 。
(4)甲同學設計一個實驗,測定上述實驗中得到的氫化鈣的純度(雜質中不含鈣元素。請完善下列實驗步驟:
①樣品稱量;②加入________溶液(填化學式),攪拌、過濾;③________(填操作名稱);④_______ (填操作名稱); ⑤稱量碳酸鈣。
(5)乙同學利用注射器測量氫化鈣和水反應氫氣體積的方法,測定上述實驗中得到的氫化鈣的純度。他稱取46 mg 所制得的氫化鈣樣品,記錄開始時注射器活栓停留在10.00mL刻度處,反應結束后充分冷卻,活栓最終停留在57.04mL刻度處(上述氣體體積均在標準狀況下測定)。試通過計算求樣品中氫化鈣的純度: 。
(6)請你再設計一種氫化鈣純度的測定方法: 。
(1)除去氫氣中的水蒸氣;防止空氣中的水蒸氣進入C裝置(2)②①④③(3)無水硫酸銅 (或其他合理答案)(4)Na2CO3(K2CO3或其他合理答案)洗滌 烘干(干燥)(5)91.3% (2分)(6)稱取一定量的樣品(m1 g),加入鹽酸溶液至不再冒氣泡,然后將溶液蒸發得到氯化鈣固體(m2 g),根據m1 、m2 即可得到氫化鈣的純度。(或其他合理答案)
【解析】
試題分析:氫化鈣要密封保存,一旦接觸到水就發生反應生成氫氧化鈣和氫氣,H2在發生加熱反應之前需要干燥,一般用無水氯化鈣,故裝置B的作用是:除去氫氣中的水蒸氣,裝置D的作用是:防止空氣中的水蒸氣進入C裝置,故答案為:除去氫氣中的水蒸氣;防止空氣中的水蒸氣進入C裝置(2)有氣體參加加熱或燃燒的反應需要首先驗純,實驗完畢后先熄火、冷卻,再停止氣體生成,防止倒吸發生爆炸,故正確的操作順序為:②①④③。(3)檢驗是否干燥用無水硫酸銅,因為無水硫酸銅遇水變藍色現象很明顯,故答案為:無水硫酸銅。(4)從最終稱量碳酸鈣可知,應加入碳酸鈉溶液,使CaH2反應的同時得到碳酸鈣沉淀,然后經過濾、洗滌、烘干、稱量,確定純度,故答案為:Na2CO3;洗滌、烘干。(5)由注射器D開始時活塞停留在10mL刻度處,反應結束后充分冷卻,活塞最終停留57.04mL刻度處,可知生成氫氣:57.04mL-10mL=47.04mL,所以氫氣的質量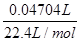 =2g/mol=0.0042g=4.2mg,設混合物中氫化鈣的質量為x,生成氫氣質量為y,則鈣的質量為46mg-x,鈣與水反應生成氫氣質量為4.2mg-y,則:
=2g/mol=0.0042g=4.2mg,設混合物中氫化鈣的質量為x,生成氫氣質量為y,則鈣的質量為46mg-x,鈣與水反應生成氫氣質量為4.2mg-y,則:
CaH2+2H2O═Ca(OH)2+2H2↑
42 4
X Y
所以42:4=x:y,整理的y=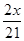
Ca+2H2O═Ca(OH)2+H2↑
40 2
46mg-x 4.2mg-y
所以40:2=(46mg-x):(4.2mg-y),將y=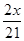 代入,解得x=42mg,所以樣品中氫化鈣的純度為:
代入,解得x=42mg,所以樣品中氫化鈣的純度為: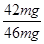 ×100%=91.30%,故答案為:91.3%
×100%=91.30%,故答案為:91.3%
(6)稱取一定量的樣品(m1g),加入鹽酸溶液至不再冒氣泡(反應完全),然后將溶液蒸發得到氯化鈣固體(m2g),根據m1、m2即可得到氫化鈣的純度,故答案為:稱取一定量的樣品(m1g),加入鹽酸溶液至不再冒氣泡(反應完全),然后將溶液蒸發得到氯化鈣固體(m2g),根據m1、m2即可得到氫化鈣的純度。
考點:制備實驗方案的設計;探究物質的組成或測量物質的含量


科目:高中化學 來源: 題型:閱讀理解

查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解

查看答案和解析>>
科目:高中化學 來源:閘北區一模 題型:問答題
查看答案和解析>>
科目:高中化學 來源:2012年上海市閘北區高考化學一模試卷(解析版) 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com