
【題目】下列各種關于酸的使用,其中正確的是
A. 為了抑制Fe2+的水解,用稀硝酸酸化 B. 檢驗溶液中是否含有SO42—時,先用鹽酸酸化
C. 檢驗氯乙烷中的氯元素,水解后再用硫酸酸化 D. 為了增強KMnO4溶液的氧化能力,用濃鹽酸酸化
科目:高中化學 來源: 題型:
【題目】為驗證鹵素單質氧化性的相對強弱,某學習小組用下圖所示裝置進行實驗(夾持儀器已略去,氣密性已檢驗)。
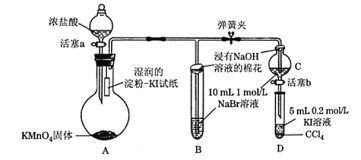
實驗過程:
Ⅰ. 打開彈簧夾,打開活塞a,滴加濃鹽酸。
Ⅱ. 當B和C中的溶液都變為黃色時,夾緊彈簧夾。
Ⅲ. 當B中溶液由黃色變為棕紅色時,關閉活塞a。
Ⅳ.……
回答問題:
(1)A中產生黃綠色氣體,其電子式是_____。實驗室在加熱條件下制取該氣體的離子方程式為_______。
(2)驗證氯氣的氧化性強于碘單質的實驗現象是____________。
(3)C中溶液發生反應的離子方程式是_______________。
(4)過程Ⅲ實驗的目的:甲同學認為試管B的作用就是吸收尾氣,防止多余Cl2污染空氣,因此B中盛裝的最佳試劑應該為________。
乙同學經分析認為,B中溶液由黃色變為棕紅色,發生反應的化學方程式為____________,以此說明C中_________,從而得出D中氧化I-的氧化劑必為Br2,因此B裝置是必不可少的。
(5)過程Ⅳ為:打開活塞b,將少量C中溶液滴入D中,關閉活塞b,取下試管D震蕩,靜置,觀察到的現象為___________,發生反應的離子方程式為_________。
(6)氯、溴、碘單質的氧化性逐漸減弱的本質原因:同主族元素從上到下_________,得電子能力逐漸減弱。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值。下列有關敘述正確的是( )
A. 20gD2O與20g氖氣所含有的電子數相同
B. 標準狀況下,22.4L二氯甲烷的分子數約為NA
C. 常溫常壓下,100g 17%的雙氧水溶液中含有氧原子總數為NA
D. 56g鐵與一定量的氯氣在一定條件下充分反應,轉移的電子數一定為3NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在兩個容積相同的容器中,一個盛有HCl氣體,另—個盛有H2和Cl2的混合氣體。在同溫同壓下, 兩容器內的氣體一定具有相同的( )
A. 原子數 B. 密度 C. 質量 D. 質子數
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學設計實驗制備2-羥基-4-苯基丁酸乙酯,反應原理、裝置和數據如下:


相對分子質量 | 密度(g/cm3) | 沸點(℃) | 水溶性 | |
2-羥基-4-苯基丁酸 | 180 | 1.219 | 357 | 微溶 |
乙醇 | 46 | 0.789 | 78.4 | 易溶 |
2-羥基-4-苯基丁酸乙酯 | 208 | 1.075 | 212 | 難溶 |
實驗步驟:
①如圖1,在干燥的圓底燒瓶中加入20mL2-羥基-4-苯基丁酸、20mL無水乙醇和適量濃硫酸,再加入幾粒沸石;
②加熱至70℃左右保持恒溫半小時;
③分離、提純三頸瓶中的粗產品,得到有機粗產品;
④精制產品。
請回答下列問題:
(1)油水分離器的作用為____________________。實驗過程中發現忘記加沸石該如何操作_______________________。
(2)本實驗采用____________加熱方式(填“水浴”、“油浴”或“酒精燈加熱”)。
(3)取三頸燒瓶中的混合物分別用水、飽和碳酸氫鈉溶液和水洗滌。第二次水洗的目的是___________________。
(4)在精制產品時,加入無水MgSO4的作用為___________________;然后過濾,再利用如圖2裝置進行蒸餾純化,圖2裝置中的錯誤有__________________________。
(5)若按糾正后的操作進行蒸餾純化,并收集212℃的餾分,得2-羥基-4-苯基丁酸乙酯約9.0g。則該實驗的產率為__________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列解釋實驗事實的方程式正確的是
A. 碳酸鈉溶液呈堿性:CO32— + 2H2O ![]() H2CO3 + 2OH-
H2CO3 + 2OH-
B. 氫氧化亞鐵在空氣中變質:2Fe(OH)2+O2+2H2O = 2Fe(OH)3
C. 銅片溶于稀硝酸產生無色氣體:Cu+4H++2NO3—=Cu2++2NO2↑+2H2O
D. 用氫氧化鈉溶液去除鋁條表面的氧化膜:Al2O3+2OH-=2AlO2-+ H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表為元素周期表的一部分,請參照元素①~⑨在表中的位置,回答問題:
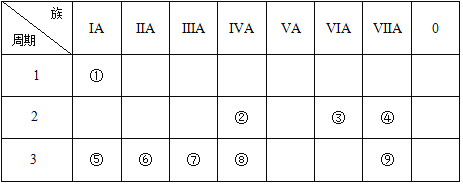
(1)表中用于半導體材料的元素在周期表中的位置__________。
(2)③、④、⑧的原子半徑最小是__________(用元素符號回答)。
(3)⑤、⑥、⑦的最高價氧化物對應的水化物,堿性最強的是________(用化學式回答)。
(4)②、③、④的氣態氫化物,穩定性最強的是__________(用結構式回答)。
(5)②和③按原子數1:2形成的化合物的電子式為____,該晶體氣化的過程中克服的微粒間作用力為______。
(6)③和⑧形成的化合物屬于__________(填“離子化合物”或“共價化合物”),該晶體屬于__________晶體(填“離子”、“分子”、“原子”)。
(7)元素⑤、⑦的最高價氧化物的水化物互相反應的離子方程式為:_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究反應2X(g)![]() Y(g)+Z(g)的速率影響因素,在不同條件下進行4組實驗,Y、Z起始濃度為0,反應物X的濃度(molL-1)隨反應時間(min)的變化情況如圖所示。
Y(g)+Z(g)的速率影響因素,在不同條件下進行4組實驗,Y、Z起始濃度為0,反應物X的濃度(molL-1)隨反應時間(min)的變化情況如圖所示。

下列說法不正確的是
A. 比較實驗②、④得出:升高溫度,化學反應速率加快
B. 比較實驗①、②得出:增大反應物濃度,化學反應速率加快
C. 若實驗②、③只有一個條件不同,則實驗③使用了催化劑
D. 在0~10min之間,實驗②的平均速率v(Y)=0.04molL-1min-1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com