
【題目】一定條件下,向某密閉容器中加入一定量的N2和H2發生可逆反應N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.2kJmol-1,并于10分鐘時達平衡。測得0到10秒內,c(H2)減小了0.75molL-1,下列說法正確的是
2NH3(g) ΔH=-92.2kJmol-1,并于10分鐘時達平衡。測得0到10秒內,c(H2)減小了0.75molL-1,下列說法正確的是
A.10到15秒內c(NH3)增加量等于0.25molL-1
B.10秒內氨氣的平均反應速率為0.025molL-1·s-1
C.達平衡后,分離出少量NH3,v正增大
D.該反應的逆反應的活化能不小于92.2kJmol-1
 全能測控期末小狀元系列答案
全能測控期末小狀元系列答案科目:高中化學 來源: 題型:
【題目】下表為長式周期表的一部分,其中的編號代表對應的元素。
① | |||||||||||||||||
② | ③ | ||||||||||||||||
④ | ⑤ | ⑥ | ⑦ | ⑧ | |||||||||||||
⑨ | ⑩ |
請回答下列問題:
(1)表中⑨號屬于______區元素。
(2)③和⑧形成的一種常見溶劑,其分子立體空間構型為________。
(3)元素①和⑥形成的最簡單分子X屬于________分子(填“極性”或“非極性”)
(4)元素⑥的第一電離能________元素⑦的第一電離能;元素②的電負性________元素④的電負性(選填“>”、“=”或“<”)。
(5)元素⑨的基態原子核外價電子排布式是________。
(6)元素⑧和④形成的化合物的電子式為________。
(7)某些不同族元素的性質也有一定的相似性,如表中元素⑩與元素⑤的氫氧化物有相似的性質。請寫出元素⑩的氫氧化物與NaOH溶液反應的化學方程式:____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】近年來,我國多地頻現種種極端天氣,二氧化碳、氮氧化物、二氧化硫是導致極端天氣的重要因素.
![]() 活性炭可用于處理大氣污染物NO,在1L恒容密閉容器中加入
活性炭可用于處理大氣污染物NO,在1L恒容密閉容器中加入![]() NO和
NO和![]() 固體活性炭
固體活性炭![]() 無雜質
無雜質![]() ,生成氣體E和氣體
,生成氣體E和氣體![]() 當溫度分別在
當溫度分別在![]() 和
和![]() 時,測得平衡時各物質的物質的量如下表:
時,測得平衡時各物質的物質的量如下表:
| 活性炭 | NO | E | F |
|
|
|
|
|
|
|
|
|
|
![]() 結合上表數據,寫出NO與活性炭反應的化學方程式 ______ ;
結合上表數據,寫出NO與活性炭反應的化學方程式 ______ ;
![]() 上述反應的平衡常數表達式
上述反應的平衡常數表達式![]() ______ ,根據上述信息判斷,
______ ,根據上述信息判斷,![]() 和
和![]() 的關系是 ______ ;
的關系是 ______ ;
A.![]() B.
B.![]() C.無法比較
C.無法比較
![]() 在
在![]() 下反應達到平衡后,下列措施能改變NO的轉化率的是 ______ ;
下反應達到平衡后,下列措施能改變NO的轉化率的是 ______ ;
![]() 增大
增大![]()
![]() 增大壓強
增大壓強![]() 升高溫度
升高溫度![]() 移去部分F
移去部分F
![]() 碘循環工藝不僅能吸收
碘循環工藝不僅能吸收![]() 降低環境污染,同時又能制得
降低環境污染,同時又能制得![]() ,具體流程如圖所示
,具體流程如圖所示

![]() 用離子方程式表示反應器中發生的反應 ______ ;
用離子方程式表示反應器中發生的反應 ______ ;
![]() 用化學平衡移動的原理分析,在HI分解反應中使用膜反應器分離出
用化學平衡移動的原理分析,在HI分解反應中使用膜反應器分離出![]() 的目的是 ______ ;
的目的是 ______ ;
![]() 開發新能源是解決大氣污染的有效途徑之一.直接甲醇燃料電池
開發新能源是解決大氣污染的有效途徑之一.直接甲醇燃料電池![]() 簡稱
簡稱![]() 由于結構簡單、能量轉化率高、對環境無污染,可作為常規能源的替代品而越來越受到關注.DMFC工作原理如圖所示
由于結構簡單、能量轉化率高、對環境無污染,可作為常規能源的替代品而越來越受到關注.DMFC工作原理如圖所示

通過a氣體的電極是原電池的 ______ 極![]() 填“正”或“負”
填“正”或“負”![]() ,b電極反應式為 ______ .
,b電極反應式為 ______ .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知某工業廢水中含有大量![]() ,較多的
,較多的![]() 及部分污泥,通過下列流程可從該廢水中回收
及部分污泥,通過下列流程可從該廢水中回收![]() 晶體及金屬Cu。
晶體及金屬Cu。

![]() 固體混合物是______
固體混合物是______![]() 填化學式
填化學式![]() ,試劑乙為______
,試劑乙為______![]() 填物質名稱
填物質名稱![]()
![]() 步驟3中發生反應的離子方程式為______
步驟3中發生反應的離子方程式為______
![]() 步驟4中涉及的操作是:蒸發濃縮、______、過濾、洗滌、干燥;蒸發濃縮、過濾操作中均用到的玻璃儀器是______
步驟4中涉及的操作是:蒸發濃縮、______、過濾、洗滌、干燥;蒸發濃縮、過濾操作中均用到的玻璃儀器是______
![]() 粗銅中常混有少量氧化亞銅
粗銅中常混有少量氧化亞銅![]() ,氧化亞銅與稀硫酸反應,會產生單質銅,同時溶液變藍。試寫出該反應的離子方程式______。
,氧化亞銅與稀硫酸反應,會產生單質銅,同時溶液變藍。試寫出該反應的離子方程式______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】厭氧氨化法(Anammox)是一種新型的氨氮去除技術,下列說法中不正確的是

A. 1mol NH4+ 所含的質子總數為10NA
B. 聯氨(N2H4)中含有極性鍵和非極性鍵
C. 過程II屬于氧化反應,過程IV屬于還原反應
D. 過程I中,參與反應的NH4+與NH2OH的物質的量之比為1:1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加徳羅常數的值,下列說法正確的是
A. 常溫下,1L pH=13的Ba(OH)2溶液中OH-數為0.2NA
B. 2.4g鎂在空氣中完全燃燒生成MgO和Mg3N2,轉移的電子數為0.2NA
C. 氫氧燃料電池正極消耗22.4L氣體時,負極消耗的氣體分子數目為2NA
D. 0.lmol/L(NH4)2SO4溶液與0.2mol/LNH4Cl溶液中的NH4+數目相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知某溫度下,某恒容容器中發生反應SO2(g)+NO2(g)![]() SO3(g)+NO(g),其平衡常數K=0.24,下列說法正確的是
SO3(g)+NO(g),其平衡常數K=0.24,下列說法正確的是
A.該溫度下反應2SO2(g)+2NO2(g)![]() 2SO3(g)+2NO(g)的平衡常數為0.48
2SO3(g)+2NO(g)的平衡常數為0.48
B.若該反應ΔH<0,則升高溫度化學平衡常數K減小
C.若升高溫度,逆反應速率減小
D.改變條件使平衡正向移動,則平衡時容器中![]() 一定比原平衡小
一定比原平衡小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一固定容積的密閉容器中充入2molA和1molB,發生反應:2A(氣)+B(氣) ![]() xC(氣),達到平衡后,C的體積分數為W%。若維持容器體積和溫度不變,按0.6molA、0.3molB和1.4molC為起始物質,達到平衡后,C的體積分數仍為W%,則x值為
xC(氣),達到平衡后,C的體積分數為W%。若維持容器體積和溫度不變,按0.6molA、0.3molB和1.4molC為起始物質,達到平衡后,C的體積分數仍為W%,則x值為
A. 1 B. 2 C. 3 D. 4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以鎳黃鐵礦為原料制備![]() 的工藝流程如下:
的工藝流程如下:
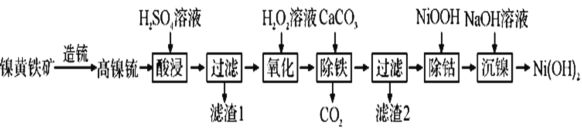
已知:①高鎳锍的主要成分為![]() 、
、![]() 、
、![]() 、
、![]() 的低價硫化物及合金;
的低價硫化物及合金;
②氧化性:![]() ;
;
③![]() ,
, ![]() ,
,![]() 。
。
回答下列問題:
(1)“酸浸”時,H2SO4溶液需過量,其目的是________。
(2)“過濾”時濾渣1的主要成分是________。
(3)“氧化”時反應的化學方程式為_________,若用NaClO代替H2O2溶液,使0.2molFe2+轉化為Fe3+,則需NaClO至少為___mol。
(4)“除鐵”的原理是_________。
(5)“除鈷”時,發生反應的離子方程式為____________。
(6)“沉鎳”后需過濾、洗滌,證明沉淀已洗滌干凈的方法是_____。若“沉鎳”后的濾液中![]() ,則濾液的pH>____
,則濾液的pH>____
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com