

分析 (1)過量NaOH溶液與SO2反應生成亞硫酸鈉與水;
(2)提高SO2平衡轉化率,促進化學平衡向右移動,根據化學平衡移動影響因素判斷;
(3)提高催化劑效率可以通過凈化氣體、控制溫度在400~500℃、增大催化劑與反應氣體的接觸面積;
(4)根據化學平衡狀態特征判斷;根據“三段式”來進行計算得出結論;
(5)根據外界條件對化學平衡的影響判斷.
解答 解:(1)過量NaOH溶液與SO2反應生成亞硫酸鈉與水,離子方程式為SO2+2OH-=SO32-+H2O,故答案為:SO2+2OH-=SO32-+H2O;
(2)提高SO2平衡轉化率,促進化學平衡向右移動,
A.正反應方向氣體體積減小,減小壓強,化學平衡向逆反應方向移動,故A錯誤;
B.正反應方向放熱,升高溫度,化學平衡向逆反應方向移動,故B錯誤;
C.增大氧氣濃度,化學平衡向右移動,故C正確;
D.減小生成物濃度,化學平衡向右移動,故D正確;
故答案為:CD;
(3)提高催化劑效率可以通過凈化氣體、控制溫度在400~500℃、增大催化劑與反應氣體的接觸面積,
故答案為:凈化氣體、控制溫度在400~500℃;增大催化劑與反應氣體的接觸面積等;
(4)①A、反應物和生成物全是氣體,氣體質量不變,容器體積不變,混合氣體密度始終不變,所以密度不變不能說明反應達到平衡狀態,故A選;
B、SO2百分含量保持不變,即各物質濃度不再發生變化,達到化學平衡狀態,故B不選;
C、反應前后氣體物質的量不同,容器中氣體的壓強不變,則達到化學平衡狀態,故C不選;
D、SO3的生成速率與SO2的消耗速率相等,均為正反應方向,不能判斷正逆反應速率是否相等,不能判斷是否平衡,故D選;
E、反應前后氣體物質的量不同,容器中氣體的物質的量不變,則達到化學平衡狀態,故E不選;
故答案為:AD;
②根據題意:2SO2(g)+O2(g)?2SO3(g),
初始物質的量:2 1 0
變化物質的量:2x x 2x
平衡物質的量:2-2x 1-x 2x
則平衡常數為K=$\frac{[S{O}_{3}]^{2}}{[S{O}_{2}]^{2}•[{O}_{2}]}$=$\frac{(\frac{2x}{2})^{2}}{(\frac{2-2x}{2})^{2}×(\frac{1-x}{2})}$=$\frac{2{x}^{2}}{(1-x)^{3}}$,
故答案為:$\frac{2{x}^{2}}{(1-x)^{3}}$;
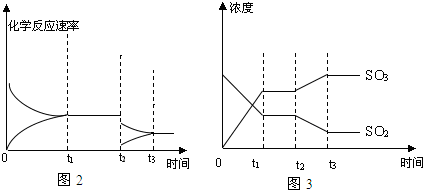
(5)圖2中時刻t2SO3濃度增大,SO2濃度減小,即化學平衡向右移動,又由于在t2時,二者濃度不變,即壓強不變,或者說,不是因為壓強變化而導致平衡的移動,只能為溫度的影響,所以條件為降低溫度,故答案為:降低溫度.
點評 本題是一道綜合性的考題,涉及化學反應速率、化學平衡常數、化學平衡的移動以及v-t圖的知識,難度較大,綜合性強.


科目:高中化學 來源: 題型:選擇題
| A. | 0.05mol/(L•s) | B. | 0.05mol/L | C. | 0.20 mol/(L•s) | D. | 0.20mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A | B | C | D | |
| 強電解質 | HCl | 酒精 | CH3COOH | NaCl |
| 弱電解質 | NH3•H2O | HClO | BaSO4 | NaOH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
 在2L的恒容密閉容器中,發生反應:A(g)+B(g)?2C(g)+D(s)△H=-a kJ•mol-1,實驗內容和結果分別如表和如圖所示.下列說法正確的是( )
在2L的恒容密閉容器中,發生反應:A(g)+B(g)?2C(g)+D(s)△H=-a kJ•mol-1,實驗內容和結果分別如表和如圖所示.下列說法正確的是( )| 實驗 序號 | 溫度 | 起始物質的量 | 熱量 變化 | |
| A | B | |||
| Ⅰ | 600℃ | 1 mol | 3 mol | 96 kJ |
| Ⅱ | 800℃ | 0.5 mol | 1.5mol | -- |
| A. | 實驗Ⅰ中,10 min內平均速率v(B)=0.06 mol•L-1•min-1 | |
| B. | 600℃時,上述方程式中a=160 | |
| C. | 600℃時,該反應的平衡常數是0.45 | |
| D. | 向實驗Ⅱ的平衡體系中再充入0.5 mol A和1.5 mol B,A的轉化率不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 為放熱反應 | |
| B. | 為吸熱反應 | |
| C. | 反應過程中熱能轉化為化學能 | |
| D. | 反應物的總能量低于生成物的總能量 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com