
(15分)、對于弱酸,在一定溫度下達到電離平衡時,各微粒的濃度存在一種定量的關系。若25℃時有HA H++A―,則K=
H++A―,則K= 。式中:K為電離平衡常數,只與溫度有關,c為各微粒的平衡濃度。下表是幾種常見弱酸的電離平衡常數(25℃)。
。式中:K為電離平衡常數,只與溫度有關,c為各微粒的平衡濃度。下表是幾種常見弱酸的電離平衡常數(25℃)。
回答下列問題:
(1)當升高溫度時,K值____(填“變大”“變小”或“不變”)。
(2)在溫度相同時,各弱酸的K值不同,那么K值的大小與酸性的相對強弱有何關系? ____ ________。
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、
H2PO4-、HPO42-都看做是酸,其中酸性最強的是_ ,最弱的是_ __。
(4)同一多元弱酸的K1、K2、K3之間存在著數量上的規律,此規律是_____________,產生此規律的原因是_____________ ___。
(5) Na2CO3溶液呈_ _(填“酸性”“堿性”或“中性”),其原因(用離子方程式表示)是_ 。
(6)已知NaH2PO4溶液呈酸性,則該溶液中c(H3PO4)____c(HPO42-)(填“大于”或“小于” )。
 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源:2014屆山東省臨沂市高二上學期期中考試化學試卷(解析版) 題型:填空題
對于弱酸,在一定溫度下達到電離平衡時,各微粒的濃度存在一種定量的關系。若25℃時有HA H++A―,則該弱酸的電離平衡常數的表達式為K=__________。下表是幾種常見弱酸的電離平衡常數(25℃)。
H++A―,則該弱酸的電離平衡常數的表達式為K=__________。下表是幾種常見弱酸的電離平衡常數(25℃)。
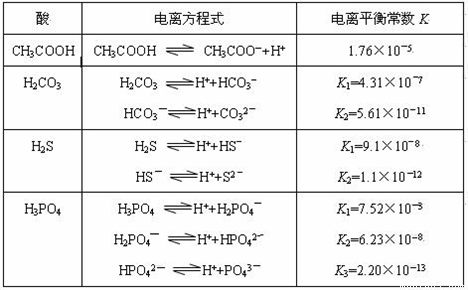
請回答下列各題:
(1)K只與溫度有關,當溫度升高時,K值______(填“增大”、“減小”或“不變”)。
(2)在溫度相同時,各弱酸的K值不同,那么K值的大小與酸性的相對強弱有何關系?_______________。
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最強的是_____________,最弱的是_____________。
(4)多元弱酸是分步電離的,每一步都有相應的電離平衡常數,對于同一種多元弱酸的K1、K2、K3之間存在著數量上的規律是K1:K2:K3≈1:10―5:10―10 ,產生此規律的原因是:________________________。
查看答案和解析>>
科目:高中化學 來源:2011-2012年海南省高二下學期期中考試理科化學試卷(解析版) 題型:填空題
(15分)、對于弱酸,在一定溫度下達到電離平衡時,各微粒的濃度存在一種定量的關系。若25℃時有HA H++A―,則K=
H++A―,則K= 。式中:K為電離平衡常數,只與溫度有關,c為各微粒的平衡濃度。下表是幾種常見弱酸的電離平衡常數(25℃)。
。式中:K為電離平衡常數,只與溫度有關,c為各微粒的平衡濃度。下表是幾種常見弱酸的電離平衡常數(25℃)。

回答下列問題:
(1)當升高溫度時,K值____(填“變大”“變小”或“不變”)。
(2)在溫度相同時,各弱酸的K值不同,那么K值的大小與酸性的相對強弱有何關系? ____ ________。
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、
H2PO4-、HPO42-都看做是酸,其中酸性最強的是_ ,最弱的是_ __。
(4)同一多元弱酸的K1、K2、K3之間存在著數量上的規律,此規律是_____________,產生此規律的原因是_____________ ___。
(5) Na2CO3溶液呈_ _(填“酸性”“堿性”或“中性”),其原因(用離子方程式表示)是_ 。
(6)已知NaH2PO4溶液呈酸性,則該溶液中c(H3PO4)____c(HPO42-)(填“大于”或“小于” )。
查看答案和解析>>
科目:高中化學 來源: 題型:
對于弱酸,在一定溫度下達到電離平衡時,各微粒的濃度存在一種定量的關系。若25℃時有HA![]() H++A―,則K=
H++A―,則K=![]() 。式中:K為電離平衡常數,只與溫度有關,c為各微粒的平衡濃度。下表是幾種常見弱酸的電離平衡常數(25℃)。
。式中:K為電離平衡常數,只與溫度有關,c為各微粒的平衡濃度。下表是幾種常見弱酸的電離平衡常數(25℃)。
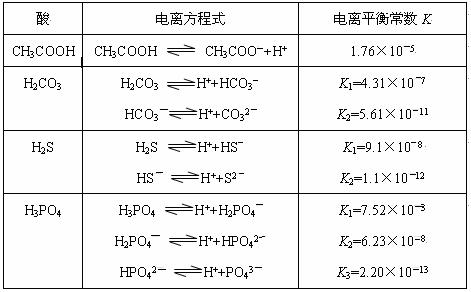
回答下列各題:
(1)K只與溫度有關,當溫度升高時,K值__________(填“增大”、“減小”、“不變”)。
(2)在溫度相同時,各弱酸的K值不同,那么K值的大小與酸性的相對強弱有何關 系?_____________________________。
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最強的是_______,最弱的是_____________。
(4)多元弱酸是分步電離的,每一步都有相應的電離平衡常數,對于同一種多元弱酸的K1、K2、K3之間存在著數量上的規律,此規律是________________,產生此規律的原因是___________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com