
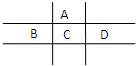
 有A、B、C、D、E五種短周期元素,且相鄰的A、B、C、D四種元素原子核外共有56個電子,在周期表中的位置如圖所示.E的氫氧化物是兩性氫氧化物,E的陽離子與A的陰離子核外電子層結構相同.
有A、B、C、D、E五種短周期元素,且相鄰的A、B、C、D四種元素原子核外共有56個電子,在周期表中的位置如圖所示.E的氫氧化物是兩性氫氧化物,E的陽離子與A的陰離子核外電子層結構相同.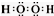 ,分子中所含共價鍵的類型為極性鍵、非金屬性鍵.
,分子中所含共價鍵的類型為極性鍵、非金屬性鍵.分析 A、B、C、D、E五種短周期元素,由圖可知,A為第二周期元素,B、C、D為第三周期元素,相鄰的A、B、C、D四種元素原子核外共有56個電子,令A的原子序數為x,則C為x+8,B為x+7,D為x+9,則x+x+8+x+7+x+9=56,解得:x=8,故A為氧元素、B為磷元素、C為硫元素、D為Cl元素,E的氫氧化物是兩性氫氧化物,E的陽離子與A的陰離子核外電子層結構相同,則E為鋁,據此進行解答.
解答 解:A、B、C、D、E五種短周期元素,由圖可知,A為第二周期元素,B、C、D為第三周期元素,相鄰的A、B、C、D四種元素原子核外共有56個電子,令A的原子序數為x,則C為x+8,B為x+7,D為x+9,則x+x+8+x+7+x+9=56,解得:x=8,故A為氧元素、B為磷元素、C為硫元素、D為Cl元素,E的氫氧化物是兩性氫氧化物,E的陽離子與A的陰離子核外電子層結構相同,則E為鋁,
(1)C為S,原子核外電子數為16,有三個電子層,最外層電子數為6,處于周期表中第三周期ⅥA族,
故答案為:第三周期ⅥA族;
(2)氧元素與氫元素能形成原子物質的量之比為1:1的化合物為H2O2,分子中O原子之間形成1對共用電子對,O原子與H原子之間形成1對共用電子對,電子式為: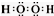 ,含有極性鍵、非金屬性,
,含有極性鍵、非金屬性,
故答案為: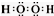 ;極性鍵、非金屬性鍵;
;極性鍵、非金屬性鍵;
(3)A為O元素、C為S元素,二者的氫化物為H2O、H2S,由于水分子中存在氫鍵,則水的沸點大于硫化氫,
故答案為:大于;H2O分子之間存在氫鍵;
(4)P、S、Cl同周期,核電荷數依次增大,故原子半徑依次減小,故原子半徑P>S>Cl,
故答案為:P>S>Cl;
(5)①若將Al制作成電極與石墨用導線相連,將兩電極插入盛有稀H2SO4的燒杯中形成原電池,Al與硫酸反應生成硫酸鋁與氫氣,Al發生氧化反應,為負極,該電池的負極的電極反應是:Al-3e-=Al3+;電池總反應為的離子方程式為:2Al+6H+=2Al3++3H2↑,
故答案為:負;2Al+6H+=2Al3++3H2↑;
②Al能夠與氫氧化鈉溶液反應生成偏鋁酸鈉和氫氣,所以能夠形成原電池,電極總反應的化學方程式為:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案為:能,2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
點評 本題考查位置結構性質的關系,涉及常用化學用語、原子半徑比較、原電池質等知識,題目難度中等,根據位置關系確定原子序數的關系進而計算推斷元素,注意整體把握元素周期表的結構.


科目:高中化學 來源: 題型:選擇題
| A. | 一定有甲酸乙酯,可能有甲醇 | B. | 四種物質都有 | ||
| C. | 有甲酸乙酯和甲酸 | D. | 有甲醇和甲酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 mol Fe與少量氯氣反應時轉移的電子數為2NA | |
| B. | 0.2 mol S在空氣中充分燃燒,轉移電子數為0.6NA | |
| C. | 0.1molCl2溶于水中發生反應,轉移電子數為0.1NA | |
| D. | 1.5 mol Na2O2與足量的二氧化碳充分反應,轉移電子數為1.5NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 反應③得到的乙酸乙酯中含有乙醇和乙酸,可用飽和氫氧化鈉溶液除去 | |
| B. | 反應②中,1mol葡萄糖可生成3mol乙醇 | |
| C. | 將在空氣中灼繞后的銅絲趁熱插入乙醇中可得到乙酸 | |
| D. | 反應①中,(C6H10O5)n可表示淀粉或纖維素 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 控制塑料購物袋的使用主要是為了節約成本 | |
| B. | 使用可降解塑料袋有利于減少“白色污染” | |
| C. | 聚氯乙烯塑料袋可用來長時間存放食品 | |
| D. | 塑料購物袋具有熱固性,不能回收利用 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
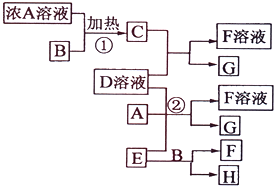 有關物質存在如圖所示的轉化關系(部分產物已省略).通常C為氣體單質,G為紫黑色固體單質.實驗室中,常用固體E在B的催化下加熱制取氣體單質H.
有關物質存在如圖所示的轉化關系(部分產物已省略).通常C為氣體單質,G為紫黑色固體單質.實驗室中,常用固體E在B的催化下加熱制取氣體單質H.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
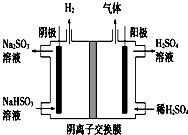 工業上用Na2SO3吸收尾氣中的SO2,再用如圖裝置電解(惰性電極)NaHSO3制取H2SO4,陰極電極反應式2H++2e-=H2↑,陽極區逸出氣體的成分為O2 SO2(填化學式).
工業上用Na2SO3吸收尾氣中的SO2,再用如圖裝置電解(惰性電極)NaHSO3制取H2SO4,陰極電極反應式2H++2e-=H2↑,陽極區逸出氣體的成分為O2 SO2(填化學式).查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com