
(12分)利用甲烷與氯氣發生取代反應制取副產品鹽酸的設想在工業上已成為現實。某化學興趣小組通過在實驗室中模擬上述過程,其設計的模擬裝置如下: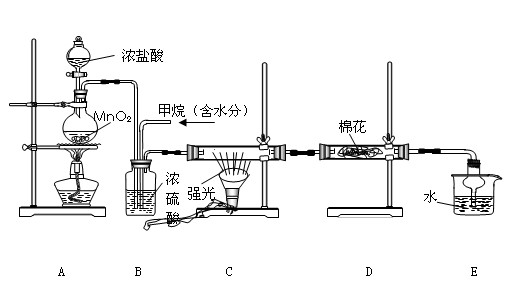
(1)寫出A裝置中發生反應的離子方程式
(2)B裝置有三種功能:①控制氣流速度;②均勻混合氣體;③
(3)設V(Cl2)/V(CH4)=x,若理論上欲獲得最多的氯化氫,則x值應≥
(4)一段時間后發現D裝置中的棉花由白色變為藍色,則棉花上可能預先滴![]() 有 溶液。
有 溶液。
(5)在C裝置中,經過一段時間的強光照射,發現硬質玻璃管內壁有黑色小顆粒產生,寫出反應的化學方程式 。
(6) E裝置中除鹽酸外,還含有有機物,從E中分離出鹽酸的最佳方法為 (填字母)。
![]() A.水洗分液法 B.蒸餾法 C.萃取分液法 D.結晶法
A.水洗分液法 B.蒸餾法 C.萃取分液法 D.結晶法
(7) 該裝置還有缺陷,原因是沒有進行尾氣處理,其尾氣主要成分為 (填字母)。
![]() A、CH4 B、CH3Cl C、CH2Cl2 D、CHCl3
A、CH4 B、CH3Cl C、CH2Cl2 D、CHCl3
 一諾書業暑假作業快樂假期云南美術出版社系列答案
一諾書業暑假作業快樂假期云南美術出版社系列答案科目:高中化學 來源: 題型:
| (1)可用改進汽油組成的辦法來改善汽油的燃燒性能,例如,加入CH3OC(CH3)3來生產“無鉛汽油”.CH3OC(CH3)3分子中必存在的原子間連接形式有 ③ ③ (填寫編號、多選倒扣). |
| (2)天然氣的燃燒產物無污染、熱值高、管道輸送方便,天然氣將成為我國西部開發的重點之一.天然氣常和石油伴生,其主要成分是 甲烷(或CH4) 甲烷(或CH4) .能說明它是正四面體而非正方形平面結構的理由是② ② (填寫編號、多選倒扣). ①其一氯代物不存在同分異構體; ②其二氯代物不存在同分異構體; ③碳原子與氫原子之間以共價鍵結合; ④四個碳氫鍵是完全等價的. (3)1980年我國首次制成一輛燃氫汽車,乘員12 人,以50 km/h的速度行駛了40 km.為了有效發展民用氫能源,首先必須制得廉價的氫氣.下面可供開發又較經濟的制氫方法是 ③ ③ (填寫編號、多選倒扣). ①電解水;②鋅和稀硫酸反應;③光解海水. 其次,制得氫氣后還需要解決的問題是 氫氣的輸送和貯存 氫氣的輸送和貯存 (寫出其中一個). |
查看答案和解析>>
科目:高中化學 來源: 題型:
(15分)工來合成氨與制備硝酸一般可連續生產,流程如下:
(1)工來生產時,制取氫氣的一個反應為:![]() ,
,
①t℃時,往l L密閉容器中充人0.2 mol CO和0.3 mol水蒸氣,反應建立平衡后,體系中c(H2)=0.12 mol?L-1,該溫度下此反應的平衡常數K= ;
②保持溫度不變,向上述平衡體系中再加入0.1 mol CO,當反應重新建立平衡時,水蒸氣的總轉化率![]() (H2O)= 。
(H2O)= 。
T(K) | T1 | 573 | T2 |
K | 1.00×107 | 2.45×105 | 1.88×103 |
(2)合成塔中發生反應為:
![]()
![]()
 右表為不同溫度下該反應的平衡常數。由此可推知,表中T1 573K(填“>”、“<”或“=”)。
右表為不同溫度下該反應的平衡常數。由此可推知,表中T1 573K(填“>”、“<”或“=”)。
(3)NH3和O2在鉑系催化劑作用下從145℃就開始反應:
![]() 4NH3+5O2
4NH3+5O2![]() NO+6H2O AH=-905kJ?mol-1,不同溫度下NO產率如圖所示,溫度高于900℃時,NO產率下降的原因 。
NO+6H2O AH=-905kJ?mol-1,不同溫度下NO產率如圖所示,溫度高于900℃時,NO產率下降的原因 。
![]() (4)吸收塔中反應為:3NO2+H2O
(4)吸收塔中反應為:3NO2+H2O![]() 2HNO3+NO。從生產流程看,吸收塔中需要補充空氣,其原因是
2HNO3+NO。從生產流程看,吸收塔中需要補充空氣,其原因是
![]() (5)硝酸廠的尾氣含有氮氧化物,不經處理直接排放將污染空氣。目前科學家探索利用燃料氣體中的甲烷將氮氧化物還原為氮氣和水,其反應機理為:
(5)硝酸廠的尾氣含有氮氧化物,不經處理直接排放將污染空氣。目前科學家探索利用燃料氣體中的甲烷將氮氧化物還原為氮氣和水,其反應機理為:
![]() CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ![]() H=-574kJ?mol-1。;
H=-574kJ?mol-1。;
![]() CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ![]() H=-1160 kJ?mol-1;
H=-1160 kJ?mol-1;
則甲烷直接將NO2還原為N2的熱化學方程式為: 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com