
下列關于C、Si兩種非金屬元素的說法中,正確的是( )
A.兩者結合形成的化合物是共價化合物
B.在自然界中都能以游離態存在
C.氫化物的熱穩定性比較:CH4<SiH4
D.最高價氧化物都能與水反應生成相應的酸
 名師金手指領銜課時系列答案
名師金手指領銜課時系列答案科目:高中化學 來源: 題型:
下列敘述正確的是( )
A.玻璃容器可長期盛放各種酸(2014·海南,9A)
B.NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃試劑瓶中(2014·天津理綜,3B)
C.金屬汞一旦灑落在實驗室地面或桌面時,必須盡可能收集,并深埋處理(2014·浙江理綜,8A)
D.盛放氯水應用帶橡膠塞的細口玻璃瓶
查看答案和解析>>
科目:高中化學 來源: 題型:
氧化還原反應廣泛應用于金屬的冶煉。下列說法不正確的是( )
A.冶煉鐵的主要原料有鐵礦石、焦炭、空氣、石灰石等,其中石灰石的作用是除去鐵礦石中的脈石(二氧化硅)
B.濕法煉銅與火法煉銅的反應中,銅元素都發生還原反應
C.工業上Mg可由電解熔融的MgO制取,Na也可由電解熔融的NaCl制取
D.鋁熱法還原鐵的反應中,放出的熱量能使鐵熔化
查看答案和解析>>
科目:高中化學 來源: 題型:
標準狀況下,將3.36 L CO2氣體通入200 mL 1.00 mol·L-1 NaOH溶液中,充分反應后溶液中c(CO )與c(HCO
)與c(HCO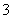 )的比值為(不考慮CO
)的比值為(不考慮CO 、HCO
、HCO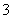 的水解)( )
的水解)( )
A.1∶1 B.1∶2
C.2∶1 D.1∶3
查看答案和解析>>
科目:高中化學 來源: 題型:
硅是帶來人類文明的重要元素之一,從傳統材料到信息材料的發展過程中創造了一個又一個奇跡。
(1)硅在元素周期表中的位置是________。
(2)工業上生產粗硅的反應有:SiO2+2C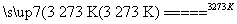 Si(粗)+2CO↑;SiO2+3C
Si(粗)+2CO↑;SiO2+3C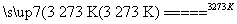 SiC+2CO↑。若產品中單質硅與碳化硅的物質的量之比為1∶1,則參加反應的C和SiO2的物質的量之比為________。
SiC+2CO↑。若產品中單質硅與碳化硅的物質的量之比為1∶1,則參加反應的C和SiO2的物質的量之比為________。
(3)工業上可以通過如圖所示的流程制取純硅:
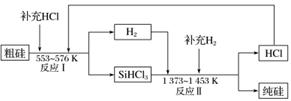
①若反應Ⅰ為Si(粗)+3HCl SiHCl3+H2,則反應Ⅱ的化學方程式為________________________。
SiHCl3+H2,則反應Ⅱ的化學方程式為________________________。
②整個制備過程中必須嚴格控制無水無氧。SiHCl3遇水劇烈反應生成H2SiO3、HCl和另一種物質,寫出該反應的化學方程式:__________________。
③假設每一輪次制備1 mol純硅,且生產過程中硅元素沒有損失,反應Ⅰ中HCl的利用率為90%,反應Ⅱ中H2的
利用率為93.75%,則在第二輪次的生產中,補充投入HCl和H2的物質的量之比是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
將足量CO2氣體通入水玻璃(Na2SiO3溶液)中,然后加熱蒸干,再在高溫下充分灼燒,最后得到的固體物質是( )
A.Na2SiO3 B.Na2CO3、Na2SiO3
C.Na2CO3、SiO2 D.SiO2
查看答案和解析>>
科目:高中化學 來源: 題型:
晶體硅是信息科學和能源科學中的一種重要材料,可用于制芯片和太陽能電池等。以下是工業上制取純硅的一種方法。
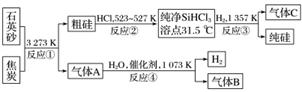
請回答下列問題(各元素用相應的元素符號表示):
(1)在上述生產過程中,屬于置換反應的有________(填反應代號)。
(2)寫出反應③的化學方程式_____________________________________________________。
(3)化合物W的用途很廣,通常可用作建筑工業和造紙工業的黏合劑,可作肥皂的填充劑,是天然水的軟化劑。將石英砂和純堿按一定比例混合加熱至1 373~1 623 K反應,生成化合物W,其化學方程式是_______________________________________________________。
(4)A、B、C三種氣體在“節能減排”中作為減排目標的一種氣體是__________(填化學式);分別通入W溶液中能得到白色沉淀的氣體是______________(填化學式)。
(5)工業上合成氨的原料H2的制法是先把焦炭與水蒸氣反應生成水煤氣,再提純水煤氣得到純凈的H2,提純水煤氣得到純凈的H2的化學方程式為________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
從海帶中提取碘單質,成熟的工藝流程如下,下列關于海水制碘的說法,不正確的是( )
干海帶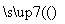 海帶灰
海帶灰 懸濁液
懸濁液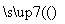 濾液
濾液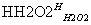 碘水
碘水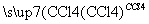 I2的CCl4溶液
I2的CCl4溶液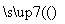 I2
I2
A.實驗室在蒸發皿中灼燒干海帶,并且用玻璃棒攪拌
B.含I-的濾液中加入稀硫酸和雙氧水后,碘元素發生氧化反應
C.在碘水中加入幾滴淀粉溶液,溶液變藍色
D.碘水加入CCl4得到I2的CCl4溶液,該操作為“萃取”
查看答案和解析>>
科目:高中化學 來源: 題型:
在容積為1.00 L的容器中,通入一定量的N2O4,發生反應N2O4(g)2NO2(g),隨溫度升高,混合氣體的顏色變深。

回答下列問題:
(1)反應的ΔH______0(填“大于”或“小于”);100 ℃時,體系中各物質濃度隨時間變化如上圖所示。在0~60 s時段,反應速率v(N2O4)為__________________ mol·L-1·s-1;反應的平衡常數K1為________________。
(2)100 ℃時達平衡后,改變反應溫度為T,c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,經10 s又達到平衡。
①T________100 ℃(填“大于”或“小于”),判斷理由是
________________________________________________________________________
________________________________________________________________________。
②列式計算溫度T時反應的平衡常數K2________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(3)溫度T時反應達平衡后,將反應容器的容積減少一半,平衡向________(填“正反應”或“逆反應”)方向移動,判斷理由是________________________________________________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com