
 (1)利用Na2SO3溶液可脫除煙氣中的SO2.Na2SO3可由NaOH溶液吸收SO2制得.NaOH溶液吸收SO2的過程中,pH隨n(SO32-):n(HSO3-)變化關系如表:
(1)利用Na2SO3溶液可脫除煙氣中的SO2.Na2SO3可由NaOH溶液吸收SO2制得.NaOH溶液吸收SO2的過程中,pH隨n(SO32-):n(HSO3-)變化關系如表:| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
分析 (1)①由表格中的數據可知,HSO3-越多,酸性越強,則電離生成氫離子;吸收液呈中性時,溶質為亞硫酸鈉和亞硫酸氫鈉,電離與水解的程度相等,結合電荷守恒解答;
②Na2SO3在溶液中存在兩步水解,以第一步水解為主;
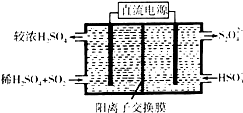
(2)①陰極上HSO3-得電子生成S2O42-;
②依據在堿性條件下,陰極排出的溶液為S2O42-,二氧化氮與其發生反應生成氮氣.
(3)①氨氣是堿性氣體,可以和酸反應生成鹽;
②氨水與SO2恰好完全反應生成正鹽,則反應生成亞硫酸銨,根據電離平衡常數判斷離子的水解平衡常數,根據水解程度相對大小確定溶液的酸堿性;
③能水解的鹽發生水解時促進水的電離.
解答 解:(1)①由表格中的數據可知,溶液呈酸性,HSO3-越多,酸性越強,是因為溶液中存在:HSO3?SO32-+H+; HSO3-+H2O?H2SO3+OH-電離程度大于水解程度,溶液顯酸性,
故答案為:酸;溶液中存在:HSO3?SO32-+H+; HSO3-+H2?H2SO3+OH-電離程度大于水解程度,故溶液顯酸性;
②Na2SO3在溶液中存在兩步水解,以第一步水解為主,SO32-+H2O?HSO3-+OH-,HSO3-+H2O?H2SO3+OH-,則溶液中離子濃度大小的關系為:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);
故答案為:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);
(2)①依據圖示可知,陰極上HSO3-得電子生成S2O42-,陰極區發生反應2HSO3-+2H++2e-=S2O42-+2H2O;
故答案為:2HSO3-+2H++2e-=S2O42-+2H2O;
②陰極排出的溶液為S2O42-,二氧化氮與其發生反應,S2O42-中硫元素由+3價,變為硫酸根中硫元素為+4價,S2O42-被氧化是還原劑;二氧化氮中的氮元素化合價為+4價變為氮氣0價,二氧化氮被還原為氧化劑,依據原子守恒和得失電子守恒可得,發生的離子方程式為4S2O42-+2NO2+8OH-═8SO42-+N2+4H2O,
故答案為:4S2O42-+2NO2+8OH-═8SO42-+N2+4H2O;
(3)①氨氣是堿性氣體,可以和磷酸反應生成鹽,產生的鹽隨著酸的磷酸的量的多少而不同,可以產生磷酸銨,磷酸氫銨或是磷酸二氫銨,
故答案為:(NH4)3PO4(或(NH4)2HPO4或NH4H2PO4);
②一水合氨的電離平衡常數大于亞硫酸氫根離子的電離 平衡常數,所以銨根離子的水解平衡常數小于亞硫酸根離子水解平衡常數,則亞硫酸根離子水解程度大于銨根離子水解程度,所以溶液呈堿性,
故答案為:堿;
③能水解的鹽發生水解時促進水的電離,則當氨水吸收SO2至恰好完全反應形成正鹽時,反應過程中生成弱酸弱堿鹽,水解促進水的電離,則H2O的電離平衡向右移動;
故答案為:向右.
點評 本題考查弱電解質的電離、鹽的水解、離子濃度大小比較、電解原理的分析應用等,比較綜合,題目難度中等,側重于考查學生的分析能力和對基礎知識的綜合應用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| A. | 大分子化合物油脂在人體內水解為氨基酸和甘油等小分子才能被吸收 | |
| B. | 硫酸廠按照規定已經處理除去了重金屬離子的酸性廢水,可直接排放入湖水中 | |
| C. | 現代科技已經能夠拍到氫鍵的“照片”,直觀地證實了水分子間的氫鍵是一個水分子中的氫原子與另一個水分子中的氧原子間形成的化學鍵 | |
| D. | 合金超導材料是指熔合兩種或兩種以上的金屬元素并形成具有超導電性的超導材料,如鈮一鈦(Nb-Ti)合金,它的熔點一般比純鈦要低 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 $→_{△}^{-H_{2}O}$CH3CH=CHCHO
$→_{△}^{-H_{2}O}$CH3CH=CHCHO +CO$→_{△}^{AlCl_{3},HCl}$
+CO$→_{△}^{AlCl_{3},HCl}$

 .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙烷與氯氣光照反應 | B. | 乙烯與氯氣加成反應 | ||
| C. | 乙烯與氫氣、氯氣混合氣體反應 | D. | 乙烯與氯化氫加成反應 |
查看答案和解析>>
科目:高中化學 來源:2016-2017學年河南省高一上月考二化學試卷(解析版) 題型:選擇題
現有H2S、NH3、CH4三種氣體,它們分別都含有相同數目的氫原子,則三種氣體的物質的量之比為( )
A. 1∶1∶1 B.2∶3∶4 C.6∶4∶3 D.6∶3∶4
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com