
【題目】海水資源的開(kāi)發(fā)和利用是當(dāng)前科學(xué)研究的一項(xiàng)重要任務(wù)。下圖是實(shí)驗(yàn)室模擬鎂開(kāi)發(fā)的流程圖:
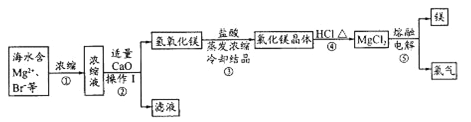
根據(jù)上述流程圖,回答下列問(wèn)題:
(1)操作I的名稱(chēng)是________。
(2)步驟中②反應(yīng)的化學(xué)方程式為________。
(3)步驟④中加熱時(shí)通入HCl氣流的作用是__________。
(4)步驟⑤的離子反應(yīng)方程式為___________。
(5)有人提出步驟⑤的副產(chǎn)物可在流程中再利用以提高海水的綜合利用率。若A為上述流程中的某組分,則A、B分別為_____________。
【答案】過(guò)濾 CaO+H2O=Ca(OH)2 MgBr2+ Ca(OH)2= Mg(OH)2↓+CaBr2(MgBr2也可是MgCl2、MgSO4等) 增大HCl濃度抑制MgCl2的水解 Mg2++2Cl-![]() Mg+Cl2↑ 濾液(或濃縮液) Br2
Mg+Cl2↑ 濾液(或濃縮液) Br2
【解析】
海水中主要有Na+,Cl-,Mg2+,Br-,SO42-等離子,蒸發(fā)濃縮后取濃縮液加CaO后會(huì)產(chǎn)生Mg(OH)2沉淀,進(jìn)行過(guò)濾,濾液中當(dāng)然含有Na+,Cl-,Br-,SO42-等離子。取所得的Mg(OH)2加HCl后進(jìn)行濃縮結(jié)晶得到MgCl2晶體。再在HCl氛圍中加熱使其失去結(jié)晶水,得到MgCl2后,再進(jìn)行電解得到Mg和Cl2。
(1)將固體和液體分開(kāi)采用過(guò)濾。
(2)步驟中②反應(yīng)的化學(xué)方程式為CaO+H2O=Ca(OH)2 MgBr2+ Ca(OH)2= Mg(OH)2↓+CaBr2。
(3)步驟④中加熱時(shí)通入HCl增大HCl濃度,在HCl氛圍中,抑制MgCl2的水解,不能直接加熱,否則MgCl2晶體會(huì)發(fā)生水解得到Mg(OH)2。
(4)步驟⑤的離子反應(yīng)方程式為Mg2++2Cl-![]() Mg+Cl2↑,在熔融狀態(tài)下MgCl2會(huì)電離出離子,所以要拆成離子形式。
Mg+Cl2↑,在熔融狀態(tài)下MgCl2會(huì)電離出離子,所以要拆成離子形式。
(5)上述流程中除了Mg,還能與Cl2反應(yīng)的只有Br-,存在于溶液中,通過(guò)Cl2置換,可以回收利用Br2。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學(xué)生10分鐘應(yīng)用題系列答案
小學(xué)生10分鐘應(yīng)用題系列答案
| 年級(jí) | 高中課程 | 年級(jí) | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:高中化學(xué) 來(lái)源: 題型:
【題目】高血脂嚴(yán)重影響人體健康,化合物E是一種臨床治療高血脂癥的藥物。E的合成路線如下(部分反應(yīng)條件和試劑略):

已知: +CO2↑(R1和R2代表烷基)
+CO2↑(R1和R2代表烷基)
請(qǐng)回答下列問(wèn)題:
(1)試劑Ⅰ的名稱(chēng)是________,試劑Ⅱ中官能團(tuán)的名稱(chēng)是________,第②步的反應(yīng)類(lèi)型是_____。
(2)第①步反應(yīng)的化學(xué)方程式是__________________________。
(3)第⑥步反應(yīng)的化學(xué)方程式是__________________________。
(4)第⑦步反應(yīng)中,試劑Ⅲ為單碘代烷烴,其結(jié)構(gòu)簡(jiǎn)式是_____________。
(5)C的同分異構(gòu)體在酸性條件下水解,生成X、Y和CH3(CH2)4OH。若X含有羧基和苯環(huán),且X和Y的核磁共振氫譜都只有兩種類(lèi)型的吸收峰,則X與Y發(fā)生縮聚反應(yīng)所得縮聚物的結(jié)構(gòu)簡(jiǎn)式是____________________。
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】300℃時(shí),將2mol A和2mol B兩種氣體混合加入2L密閉容器中,發(fā)生反應(yīng)3A(g)+B(g)![]() 2C(g)+2D(g)△H,2min末反應(yīng)達(dá)到平衡,生成0.8mol D。(用三段式解答。)
2C(g)+2D(g)△H,2min末反應(yīng)達(dá)到平衡,生成0.8mol D。(用三段式解答。)
(1)求該反應(yīng)的平衡常數(shù)____。
(2)求平衡時(shí)A的轉(zhuǎn)化率____。
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】一定溫度下,某容積為2L的密閉容器內(nèi),某一反應(yīng)中M、N(均為氣體)的物質(zhì)的量隨反應(yīng)時(shí)間變化的曲線如圖,如圖所示:

(1)該反應(yīng)的化學(xué)方程式是__________。
(2)在圖上所示的三個(gè)時(shí)刻中,_____(填t1、t2或t3)時(shí)刻處于平衡狀態(tài),t2時(shí)刻V(生成M)____V(消耗M)(填>、<或=);
(3)若反應(yīng)容器的容積不變,則“壓強(qiáng)不再改變”_______(填“能”或“不能”)作為該反應(yīng)已達(dá)到平衡狀態(tài)的判斷依據(jù)。
(4)下列措施能增大反應(yīng)速率的是_____(選填字母)。
A.升高溫度 B.降低壓強(qiáng) C.減小M的濃度 D.將反應(yīng)容器體積縮小
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】常溫時(shí),下列敘述正確的是![]()
A.![]() 的
的![]() 與
與![]() 混合溶液中
混合溶液中![]()
B.![]() 的可樂(lè)中
的可樂(lè)中![]() 是
是![]() 的檸檬水中
的檸檬水中![]() 的10倍
的10倍
C.AgCl在![]()
![]() 溶液和
溶液和![]() NaCl溶液中的溶解度相同
NaCl溶液中的溶解度相同
D.![]() 溶液加水稀釋至100mL,pH和
溶液加水稀釋至100mL,pH和![]() 均減小
均減小
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】膽礬是一種常見(jiàn)的化合物,工業(yè)上它也是一種制取其它含銅化合物的原料,現(xiàn)有廢銅(主要雜質(zhì)為Fe)來(lái)制備膽礬。有人設(shè)計(jì)了如下流程:
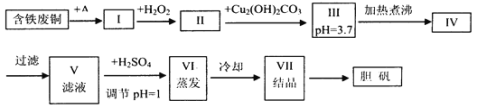
pH值控制可參考下列數(shù)據(jù)
物質(zhì) | 開(kāi)始沉淀時(shí)的pH值 | 完全沉淀時(shí)的pH值 |
氫氧化鐵 | 2.7 | 3.7 |
氫氧化亞鐵 | 7.6 | 9.6 |
氫氧化銅 | 5.2 | 6.4 |
請(qǐng)根據(jù)上述流程回答下列問(wèn)題:
(1)A可選用__(填字母)
a.稀H2SO4 b.濃H2SO4、加熱 c.濃FeCl3溶液 d.濃HNO3
(2)Ⅰ中加H2O2的目的__。
(3)Ⅱ中加Cu2(OH)2CO3的目的是__,其優(yōu)點(diǎn)是__。
(4)Ⅲ加熱煮沸時(shí)發(fā)生的化學(xué)反應(yīng)的離子方程式為__。
(5)V中加H2SO4調(diào)節(jié)pH=1是為了__。
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】用軟錳礦![]() 主要成分為
主要成分為![]() 生產(chǎn)高錳酸鉀產(chǎn)生的錳泥中,還含有
生產(chǎn)高錳酸鉀產(chǎn)生的錳泥中,還含有![]() 的
的![]() 、
、![]() 的
的![]() 均為質(zhì)量分?jǐn)?shù)
均為質(zhì)量分?jǐn)?shù)![]() ,及少量Cu、Pb的化合物等,用錳泥可回收制取
,及少量Cu、Pb的化合物等,用錳泥可回收制取![]() ,過(guò)程如圖:
,過(guò)程如圖:
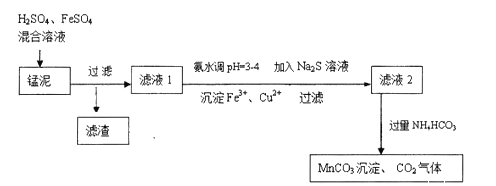
![]() 高錳酸鉀的氧化性強(qiáng)弱與溶液的酸堿性有關(guān),在酸性條件下其氧化性較強(qiáng),通常用來(lái)酸化高錳酸鉀的酸是 ______ .
高錳酸鉀的氧化性強(qiáng)弱與溶液的酸堿性有關(guān),在酸性條件下其氧化性較強(qiáng),通常用來(lái)酸化高錳酸鉀的酸是 ______ .
![]() 除去濾液1中
除去濾液1中![]() 的離子方程式是 ______ .
的離子方程式是 ______ .
![]() 經(jīng)實(shí)驗(yàn)證明:
經(jīng)實(shí)驗(yàn)證明:![]() 稍過(guò)量時(shí),起始
稍過(guò)量時(shí),起始![]() 、
、![]() 混合溶液中
混合溶液中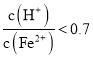 時(shí),濾液1中能夠檢驗(yàn)出有
時(shí),濾液1中能夠檢驗(yàn)出有![]() ;
;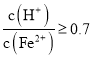 時(shí),濾液1中不能檢驗(yàn)出有
時(shí),濾液1中不能檢驗(yàn)出有![]() 根據(jù)上述信息回答①②③:
根據(jù)上述信息回答①②③:
①檢驗(yàn)![]() 是否氧化完全的實(shí)驗(yàn)操作是 ______ .
是否氧化完全的實(shí)驗(yàn)操作是 ______ .
②生產(chǎn)時(shí)![]() 、
、![]() 混合溶液中
混合溶液中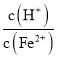 應(yīng)控制在
應(yīng)控制在![]() 之間,不宜過(guò)大,請(qǐng)結(jié)合后續(xù)操作從節(jié)約藥品的角度分析,原因是 ______ .
之間,不宜過(guò)大,請(qǐng)結(jié)合后續(xù)操作從節(jié)約藥品的角度分析,原因是 ______ .
③若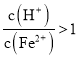 ,調(diào)節(jié)
,調(diào)節(jié)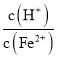 到
到![]() 的最理想試劑是 ______
的最理想試劑是 ______ ![]() 填序號(hào)
填序號(hào)![]()
![]() 溶液
溶液 ![]() 鐵粉
鐵粉 ![]()
![]() 寫(xiě)出濾液2中加入過(guò)量
寫(xiě)出濾液2中加入過(guò)量![]() 反應(yīng)的離子方程式: ______ .
反應(yīng)的離子方程式: ______ .
![]() 上述過(guò)程錳回收率可達(dá)
上述過(guò)程錳回收率可達(dá)![]() ,若處理1740kg的錳泥,可生產(chǎn)
,若處理1740kg的錳泥,可生產(chǎn)![]() ______ kg.
______ kg.
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】在固定容積的密閉容器中,可逆反應(yīng)2X +Y(g)![]() Z(s)已達(dá)到平衡,此時(shí)升高溫度則氣體混合物的密度增大。下列敘述正確的是( )
Z(s)已達(dá)到平衡,此時(shí)升高溫度則氣體混合物的密度增大。下列敘述正確的是( )
A.若X為非氣態(tài),則正反應(yīng)為吸熱反應(yīng)
B.正反應(yīng)為放熱反應(yīng),X一定為氣態(tài)
C.正反應(yīng)為放熱反應(yīng),X可能是氣態(tài)、液態(tài)或固態(tài)
D.若加入少量的Z,該平衡向左移動(dòng)
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】將等物質(zhì)的量的A、B、C、D四種物質(zhì)混合,發(fā)生如下反應(yīng):aA+bB![]() cC(s)+dD,當(dāng)反應(yīng)進(jìn)行一定時(shí)間后,測(cè)得A減少了nmol,B減少了
cC(s)+dD,當(dāng)反應(yīng)進(jìn)行一定時(shí)間后,測(cè)得A減少了nmol,B減少了![]() n mol,C增加了
n mol,C增加了![]() n mol,D增加了n mol,此時(shí)達(dá)到化學(xué)平衡。請(qǐng)?zhí)顚?xiě)下列空白:
n mol,D增加了n mol,此時(shí)達(dá)到化學(xué)平衡。請(qǐng)?zhí)顚?xiě)下列空白:
(1)該化學(xué)方程式各物質(zhì)的化學(xué)計(jì)量數(shù)為a=_____、b=______、c=_____、d=______。
(2)若只改變壓強(qiáng),反應(yīng)速率發(fā)生變化,但平衡不發(fā)生移動(dòng),該反應(yīng)中物質(zhì)D的聚集狀態(tài)為______。
(3)若只升高溫度,反應(yīng)一段時(shí)間后,測(cè)知四種物質(zhì)其物質(zhì)的量又達(dá)到相等,則該反應(yīng)為________反應(yīng)(填“放熱”或“吸熱”)。
查看答案和解析>>
百度致信 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專(zhuān)區(qū) | 電信詐騙舉報(bào)專(zhuān)區(qū) | 涉歷史虛無(wú)主義有害信息舉報(bào)專(zhuān)區(qū) | 涉企侵權(quán)舉報(bào)專(zhuān)區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com