
| 0.03×0.03×0.03 |
| 0.06 |


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
| A、甲酸能與水以任意比互溶 |
| B、1mol/L甲酸溶液的PH約為2 |
| C、10mL1mol/L甲酸恰好與10mL1mol/LNaOH溶液完全反應 |
| D、在相同條件下,甲酸溶液的導電性比強酸溶液的弱 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、④⑥ | B、②⑥ | C、①③ | D、①⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:
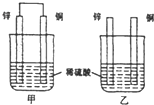 原電池原理的發現是儲能和供能技術的巨大進步,是化學對人類的一項重大貢獻.
原電池原理的發現是儲能和供能技術的巨大進步,是化學對人類的一項重大貢獻.查看答案和解析>>
科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
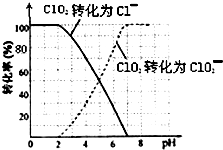 二氧化氯(ClO2)是一種在水處理等方面有廣泛應用的高效安全消毒劑.比Cl2更好.
二氧化氯(ClO2)是一種在水處理等方面有廣泛應用的高效安全消毒劑.比Cl2更好.查看答案和解析>>
科目:高中化學 來源: 題型:
2- 4 |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com