
【題目】磷能形成多種含氧酸。
(1)一元中強酸次磷酸(H3PO2)是一種精細化工產品,向10 mL H3PO2溶液中加入10 mL等物質的量濃度的NaOH溶液后,所得的溶液中只有H2PO2-、OH-兩種陰離子。
① 寫出H3PO2溶液與足量NaOH 溶液反應后形成的正鹽的化學式:_______,該正鹽溶液中各離子濃度由大到小的順序為____________。
② 若25℃時,K (H3PO2) = 1×10-2,則0.01 mol · L-1的H3PO2溶液的pH =________。
(2)亞磷酸(H3PO3)是二元中強酸,25℃時亞磷酸的電離常數為K1= 3.7×10-2、K2=2.6×10-7。
試從電離平衡移動的角度解釋K1、K2數據的差異______________。
(3) 25 ℃時,HF的電離常數為K = 3.6×10-4; H3PO4的電離常數為K1=7.5×10-3,K2=6.2×10-8,K3=4.4×10-13。足量NaF溶液和H3PO4溶液反應的離子方程式為______。
(4)相同溫度下,等物質的量濃度的上述三種磷的含氧酸中。c(H+)由大到小的順序為______________________________________________________(用酸的分子式表示)。
【答案】NaH2PO2 c(Na+)>c(H2PO2-)>c(OH-)>c(H+) 2 H3PO3第一步電離出的H+對第二步電離起到抑制作用 F- +H3PO4 =HF+H2PO4- H3PO3 >H3PO2 >H3PO4
【解析】
(1)①向10mL H3PO2溶液中加入10mL等物質的量濃度的NaOH溶液后,所得的溶液中只有H2PO2-、OH-兩種陰離子,H3PO2是一元中強酸,H3PO2溶液與足量NaOH 溶液反應后形成的正鹽為NaH2PO2;
酸根離子水解導致溶液呈堿性,但其水解程度較小;
②該溶液中c(H+)=![]() ,pH=-lgc(H+);
,pH=-lgc(H+);
(2)第一步電離出的氫離子抑制第二步電離;
(3)HF的電離平衡常數小于磷酸的第一步電離平衡常數大于其第二步、第三步電離平衡常數,所以NaF和磷酸反應生成HF和磷酸二氫鈉;
(4)相同濃度的這三種含磷的酸中,其電離平衡常數越大,氫離子濃度越大。
(1)①向10mL H3PO2溶液中加入10mL等物質的量濃度的NaOH溶液后,所得的溶液中只有H2PO2-、OH-兩種陰離子,H3PO2是一元中強酸,H3PO2溶液與足量NaOH 溶液反應后形成的正鹽為NaH2PO2;
酸根離子水解導致溶液呈堿性,但其水解程度較小,離子濃度大小順序是c(Na+)>c(H2PO2-)>c(OH-)>c(H+);
②該溶液中c(H+)=![]() ,pH=-lgc(H+)=-lg
,pH=-lgc(H+)=-lg![]() =2;
=2;
(2)第一步電離出的氫離子抑制第二步電離,所以第一步電離平衡常數與第二步電離平衡常數相差較大,因為:H3PO3第一步電離出的H+對第二步電離起到抑制作用;
(3)HF的電離平衡常數小于磷酸的第一步電離平衡常數大于其第二步、第三步電離平衡常數,所以NaF和磷酸反應生成HF和磷酸二氫鈉,離子方程式為F-+H3PO4=HF+H2PO4-;
(4)相同濃度的這三種含磷的酸中,其電離平衡常數越大,氫離子濃度越大,電離平衡常數(多元酸看第一步電離平衡常數)H3PO3>H3PO2>H3PO4,則酸性H3PO3>H3PO2>H3PO4,相同濃度的這幾種酸中氫離子濃度H3PO3>H3PO2>H3PO4。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】下列反應在任何溫度下均能自發進行的是
A. 2N2(g)+O2(g)===2N2O(g) ΔH=+163 kJ·mol-1
B. Ag(s)+Cl2(g)===AgCl(s) ΔH=-127 kJ·mol-1
C. HgO(s)===Hg(l)+O2(g) ΔH=+91 kJ·mol-1
D. H2O2(l)===O2(g)+H2O(l) ΔH=-98 kJ·mol-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學通過如下流程制備氧化亞銅:

已知CuCl難溶于水和稀硫酸:Cu2O+2H+==Cu2++Cu+H2O
下列說法不正確的是
A. 步驟②SO2可用Na2SO3替換
B. 步驟③中為防止CuCl被氧化,可用SO2水溶液洗滌
C. 步驟④發生反應的離子方程式為2CuCl+2OH-=Cu2O+2Cl-+H2O
D. 如果Cu2O試樣中混有CuCl和CuO雜質,用足量稀硫酸與Cu2O試樣充分反應,根據反應前、后固體質量可計算試樣純度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】微生物燃料電池是指在微生物的作用下將化學能轉化為電能的裝置。某微生物燃料電池的工作原理如圖所示,下列說法正確的是

A. 電子從b流出,經外電路流向a
B. HS-在硫氧化菌作用下轉化為SO42-的反應是HS-+4H2O-8e-=SO42-+9H+
C. 如果將反應物直接燃燒,能量的利用率不會變化
D. 若該電池電路中有0.4mol電子發生轉移,則有0.5molH+通過質子交換膜
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】砷和鎳均為重要的無機材料,在化工領域具有廣泛的應用。
(1)基態As原子的價層電子的電子云輪廓圖形狀為_____________。與砷同周期的主族元素的基態原子中,第一電離能最大的為_____________(填元素符號。)
(2)Na3AsO3可用于碘的微量分析。
①Na+的焰色反應呈黃色,金屬元素能產生焰色反應的微觀原因為__________________________。
②Na3AsO3中所含陰離子的立體構型為_____________,寫出一種與其互為等電子體的分子:_____________(填化學式)。
(3) 可用于合成Ni2+的配體,M中C原子的雜化方式為___________,其所含
可用于合成Ni2+的配體,M中C原子的雜化方式為___________,其所含![]() 鍵和π鍵的數目之比為___________。
鍵和π鍵的數目之比為___________。
(4)Ni與Ca處于同一周期,且核外最外層電子構型相同,但金屬Ni的熔點和沸點均比金屬Ca的高,其原因為___________。區分晶體Ni和非晶體Ni的最可靠的科學方法為___________。
(5)某砷鎳合金的晶胞結構如下圖所示,設阿伏加德羅常數的值為NA,則該晶體的密度ρ=___________g·cm-3。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,將20mL 0.10 mol/LCH3COOH溶液和20mL 0.10 mol/LHX溶液分別與20mL 0.10 mol/LNaHCO3溶液混合,測得產生氣體的體積(V)隨時間(t)變化如下圖,下列說法中不正確的是
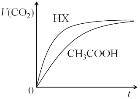
A. 反應開始前,HX溶液中c(H+)大于CH3COOH中c(H+)
B. CH3COOH溶液反應結束后,c(Na+)>c(CH3COO—)
C. 反應結束后所得兩溶液中,c(CH3COO—)<c(X—)
D. 由該實驗可知HX為強酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,在固定容積的密閉容器中,可逆反應: mA(氣)+nB(氣) ![]() pC(氣)+qD(氣),當m、n、p、q為任意正整數時,下列狀態:①體系的壓強不再發生變化, ②體系的密度不再發生變化, ③各組分的物質的量濃度不再改變, ④各組分的質量分數不再改變,⑤反應速率vA:vB:vC:vD=m:n:p:q,其中,能說明反應已達到平衡的是
pC(氣)+qD(氣),當m、n、p、q為任意正整數時,下列狀態:①體系的壓強不再發生變化, ②體系的密度不再發生變化, ③各組分的物質的量濃度不再改變, ④各組分的質量分數不再改變,⑤反應速率vA:vB:vC:vD=m:n:p:q,其中,能說明反應已達到平衡的是
A. ③④ B. ②③④ C. ①②③④ D. ①②③④⑤
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氫能被視為最具發歸力的清潔能源,開發新型儲氣材料是氫能利用的重要研究方向。請回答下列問題:
Ⅰ.化合物A(H3BNH3)是一種潛在的儲氫材料,可由六元環狀物質(HB=NH)3通過如 下反應制得:3CH4+2 (HB=NH) 3+6H2O=3CO2+6H3BNH3
(1)基態B原子的價電子排布式為___________,B、C, N, O第一電離能由大到小的順序為_________,CH4、H2O、CO2的鍵角按照由大到小的順序排列為___________。
(2)與(HB=NH)3,互為等電子體的有機分子為___________(填分子式)。
Ⅱ.氫氣的安全貯存和運輸是氫能應用的關鍵。
(1)印度尼赫魯先進科學研宄中心的Datta和Pati等人借助ADF軟件對一種新 型環烯類儲氫材料(C16S8)進行研宄,從理論角度證明這種材料的分子呈平面結構(如圖),每個雜環平面上下兩側最多可吸附10個H2分子。

①C16S8分子中C原子和S原子的雜化軌道類型分別為___________。
②相關鍵長數據如表所示:
化學鍵 | C-S | C=S | C16S8中碳硫鍵 |
鍵長/pm | 181 | 155 | 176 |
從表中數據看出,C16S8中碳硫鍵鍵長介于C—S鍵與C=S鍵之間,原因可能______________________。
③C16S8與H2微粒間的作用力是___________。
(2)有儲氫功能的銅合金晶體具有立方最密堆積結構,晶胞中Cu原子位于面心,Ag 原子位于頂點,氫原子可進到由Cu原子與Ag原子構成的四面體空隙中。該晶體儲氫后的晶胞結構與CaF2(如圖)相似,該晶體儲氫后的化學式為___________。


(3)MgH2是金屬氫化物儲氫材料,其晶胞如上圖所示,該晶體的密度為agcm-3,則晶胞的體積為___________cm3(用含a、NA的代數式表示,NA表示阿伏加德羅常數的值)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法不正確的是
A. 已知冰的熔化熱為6.0kJ·mol-1,冰中氫鍵鍵能為20kJmol-1,假設每摩爾冰中有2mol氫鍵,且熔化熱完全用于打破冰的氫鍵,則最多只能破壞冰中15%的氫鍵
B. 已知一定溫度下,醋酸溶液的物質的量濃度為c,電離度為a,Ka=(ca)2/c(1-a)。若加水稀釋,,則CH3COOH![]() CH3COO-+H+向右移動,a增大,Ka不變
CH3COO-+H+向右移動,a增大,Ka不變
C. 甲烷的標準燃燒熱為-890.3kJ·mol-1,則甲烷燃燒的熱化學方程式可表示為:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ·mol-1
D. 500℃、30MPa下,將0.5molN2和1.5molH2置于密閉的容器中充分反應生成NH3(g),放熱19.3kJ,其熱化學方程式為:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6kJ·mol-1
2NH3(g) △H=-38.6kJ·mol-1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com