

分析 (1)Fe3+遇KSCN溶液變血紅色,據此檢驗Fe3+;
(2)CuSO4溶液中逐滴加入氨水先生成氫氧化銅,再加過量的氨水氨水與氫氧化銅生成銅氨絡離子;
(3)①加熱時氨氣易揮發,使平衡-[Cu(NH3)4]2+?Cu2++4NH3.向正反應方向移動,且加熱時,Cu2+水解程度變大;
②根據題中圖2可知,溶液中乙醇含量越高,絡氨銅在乙醇-水混合溶劑中的溶解度越小,洗滌時既要能除去固體表面可溶的雜質雜質,又要盡可能減少晶體因溶解而損失,據此選擇試劑;
(4)氨含量的測定過程中,根據0.1200mol•L-1的NaOH溶液VL,計算出與之反應的鹽酸,再根據鹽酸的總量為30.00mL×0.5000mol.L-1=0.015mol可計算得與氨氣反應的鹽酸,并由此計算出樣品中的氨的質量,根據絡氨銅樣品中氨的質量分數=$\frac{氨的質量}{樣品質量}$×100%計算.
解答 解:(1)Fe3+遇KSCN溶液變血紅色,所以檢驗CuSO4溶液中是否含有Fe3+的方法為取適量溶液,滴加KSCN溶液,如果溶液變紅,說明含有Fe3+,反之則無,
故答案為:取適量溶液,滴加KSCN溶液,如果溶液變紅,說明含有Fe3+,反之則無;
(2)CuSO4溶液中逐滴加入氨水先生成氫氧化銅,再加過量的氨水氨水與氫氧化銅生成銅氨絡離子,所以反應現象為隨著氨水的滴入,產生藍色絮狀沉淀;氨水過量后,藍色沉淀又溶解,溶液變深藍色,
故答案為:隨著氨水的滴入,產生藍色絮狀沉淀,氨水過量后,藍色沉淀又溶解,溶液變深藍色;
(3)①加熱時氨氣易揮發,使平衡-[Cu(NH3)4]2+?Cu2++4NH3向正反應方向移動,且加熱時,Cu2+水解程度變大,導致晶體中有Cu2(OH)2SO4雜質,
故答案為:加熱蒸發過程中NH3揮發,使反應[Cu(NH3)4]2+?Cu2++4NH3平衡往右移動,且Cu2+發生水解;
②根據題中圖2可知,溶液中乙醇含量越高,絡氨銅在乙醇-水混合溶劑中的溶解度越小,所以要從絡氨銅溶液中析出絡氨銅晶體,向溶液中加入無水乙醇,洗滌時既要能除去固體表面可溶的雜質雜質,又要盡可能減少晶體因溶解而損失,所以洗滌絡氨銅晶體用乙醇和水的混合液,故選C,洗滌時用用膠頭滴管吸收少量乙醇溶液滴在固體上至浸沒固體,待洗液濾出后,重復2~3次,
故答案為:無水乙醇;C;用膠頭滴管吸收少量乙醇溶液滴在固體上至浸沒固體,待洗液濾出后,重復2~3次;
(4)0.1200mol•L-1的NaOH溶液VL,可以中和掉的鹽酸的物質的量為0.12Vmol,溶液中鹽酸的總量為30.00mL×0.5000mol.L-1=0.015mol,所以與氨氣反應的鹽酸的物質的量為0.015mol-0.12Vmol,所以樣品中的氨的質量為(0.015-0.12V)×17g,所以絡氨銅樣品中氨的質量分數為$\frac{(0.015-0.12V)×17g}{ag}$=$\frac{17(0.015-0.12V)}{a}$,
故答案為:$\frac{17(0.015-0.12V)}{a}$.
點評 本題考查物質的制備,涉及化學平衡移動、結晶方式的分析、化學計算等,弄清實驗原理、目的、要求、步驟和注意事項是解題的關鍵,中等難度.


科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
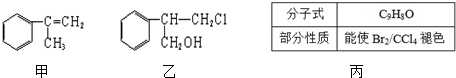
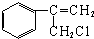 $→_{Ⅱ}^{一定條件}$Y$→_{Ⅲ}^{一定條件}$乙
$→_{Ⅱ}^{一定條件}$Y$→_{Ⅲ}^{一定條件}$乙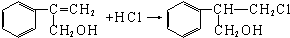 _(不需注明反應條件).
_(不需注明反應條件).查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 硫酸 純堿 燒堿 | B. | 硝酸 燒堿 氯化鈉 | ||
| C. | 醋酸 酒精 碳酸鈣 | D. | 鹽酸 熟石灰 苛性鈉 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 青蒿素 | B. | 青霉素 | C. | 蝦青素 | D. | 維生素 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 高錳酸鉀是一種用途廣泛的強氧化劑,實驗室制備高錳酸鉀所涉及的化學方程式如下:
高錳酸鉀是一種用途廣泛的強氧化劑,實驗室制備高錳酸鉀所涉及的化學方程式如下:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | $\frac{3{V}_{1}-{V}_{2}}{{V}_{1}+{V}_{2}}$ | |
| B. | $\frac{({V}_{1}+{V}_{2})×1{0}^{-14}}{{V}_{2}-3{V}_{1}}$ | |
| C. | $\frac{({V}_{1}{P}_{1}+{V}_{2}{P}_{2})×1{0}^{-14}}{({V}_{2}-3{V}_{1}){P}_{3}}$ | |
| D. | $\frac{({V}_{1}{P}_{1}+{V}_{2}{P}_{2})×1{0}^{-14}}{(3{V}_{1}-{V}_{2}){P}_{3}}$ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com