
某溶液中大量存在以下濃度的五種離子:0.4mol/L Cl﹣、0.8mol/L SO42﹣、0.2mol/L A l3+、0.6mol/L H+、M,則M及其物質的量濃度可能為( )
l3+、0.6mol/L H+、M,則M及其物質的量濃度可能為( )
A.Na+0.6mol/L B.CO32﹣ 0.2 mol/L
C.Mg2+0.4 mol/L D.Ba2+0.4mol/L
科目:高中化學 來源:2016-2017學年福建省等三校高一上聯考二化學卷(教師版) 題型:填空題
(1)已知物質由H、C、Na、O、Cl、Fe元素中的一種或幾種組成。請按要求回答。
①酸性氧化物的化學式 。(寫一種,下同)
②有機物的化學式 。
③堿性氧化物與酸反應的離子方程式 。
(2)依據題意填空。
①填入合適的符號。 + 2H+ = CO2↑+ H2O + Ba2+
②寫出離子方程式為Cu2+ + 2OH- =Cu(OH)2↓的化學方程式。 (寫一個)
③用氯化鐵溶液腐蝕銅線路板的離子方程式為________________。
④將氯氣通入NaOH 溶液中可生產消毒液。寫出發生反應的離子方程式______________,并用單線橋或雙線橋標出電子轉移的方向和數目。_____________________
(3)選擇合適的試劑除去下列括號內的雜質。
選擇的試劑 | 操作 | 選擇的試劑 | |
①Cu(Fe) | ②CO2氣體(HCl) |
查看答案和解析>>
科目:高中化學 來源:2016-2017學年遼寧省沈陽市城郊市重點聯合體高一上期中化學卷(解析版) 題型:實驗題
用質量分數98%、密度為1.84g·cm-3的濃硫酸配制480mL0.92mol·L-1的稀硫酸
(1)配制時,除量筒、燒杯、玻璃棒外還需玻璃儀器有 、 、 。
(2)減小誤差量取時需選用合適的量筒量取 mL濃硫酸
(3)在容量瓶的使用方法中,下列操作不正確的是________。
A.使用容量瓶前檢查它是否漏水 |
B.容量瓶用蒸餾水洗凈后,再用待配溶液潤洗 |
C.配制溶液時,如果試樣是固體,把稱好的試樣用紙條小心倒入容量瓶中,緩慢加入蒸餾水到接近標線1~2cm處,改用膠頭滴管加蒸餾水到標線 |
D.往容量瓶中轉移溶液時應用玻璃棒引流 |
(4)在配制過程中,其他操作都是正確的,下列操作會引起誤差偏高的是__________。
①轉移溶液時不慎有少量灑到容量瓶外面 ②沒有洗滌燒杯和玻璃棒③定容時俯視刻度線④容量瓶不干燥,含有少量蒸餾水⑤定容后塞上瓶塞反復搖勻,靜置后,液面低于刻度線,再加水至刻度線。⑥未冷卻到室溫就將溶液轉移到容量瓶并定容
查看答案和解析>>
科目:高中化學 來源:2016-2017學年遼寧省沈陽市城郊市重點聯合體高一上期中化學卷(解析版) 題型:選擇題
下列關于膠體的敘述不正確的是
A.布朗運動不是膠體微粒特有的運動方式。
B.光線透過膠體時,發生丁達爾效應,是因為粒子對光的散射造成的
C.膠體粒子能透過濾紙,所以不能用過濾的方法分離膠體和溶液
D.膠體能發生電泳,所以膠體帶電荷,不在呈現電中性。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年江西省南昌市等五校高一上聯考二化學試卷(解析版) 題型:填空題
圍繞下列七種物質:①鋁,②NaHCO3溶液,③稀硝酸,④H2SO4,⑤熔融Ba(OH)2 ,⑥NaOH溶液,⑦A12(SO4)3固體 ,根據要求回答下列問題。
(1)既能與強酸反應,又能與強堿反應的是 (填序號)。
(2)屬于電解質的是 (填序號)。
(3)寫出①和⑥反應的離子方程式 。
(4)34.2g⑦溶于水配成500mL溶液,溶液中SO42-的物質的量濃度為 。
(5)①與③發生反應的化學方程式為A1+4HNO3=A1(NO3)3+NO↑+2H2O,該反應中還原劑與氧化劑的 物質的量之比是 。
物質的量之比是 。
(6)除去②中的Na2CO3,相關的化學方程式為 。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年江西省南昌市等五校高一上聯考二化學試卷(解析版) 題型:選擇題
某溶液與金屬鋁反應能放出氫氣,則在該溶液中一定能大量共存的離子 組是( )
組是( )
A.NH4+、NO3-、CO32-、Na+ B.Na+、Ba2+、Cl-、SO42-
C.NO3-、K+、Cl-、Na+ D.HCO3-、K+、NO3-、Al3+
查看答案和解析>>
科目:高中化學 來源:2016-2017學年江西省高二上學期期中化學試卷(解析版) 題型:填空題
(1)目前國際空間站處理CO2的一個重要方法是將CO2還原,所涉及的反應方程式為:CO2(g)+4H2(g)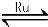 CH4(g)+2H2O(g) △H﹤0
CH4(g)+2H2O(g) △H﹤0
則升高溫度平衡體系中H2的體積分數將___________;(選填“增大”、“減小”或“不變”)
(2)相同溫度時,上述反應在不同起始濃度下分別達到平衡,各物質的平衡濃度如下表:
[CO2]/mol·L-1 | [H2]/mol·L-1 | [CH4]/mol·L-1 | [H2O]/mol·L-1 | |
平衡Ⅰ | a | b | c | d |
平衡Ⅱ | m | n | x | y |
a、b、c、d與m、n、x、y之間的關系式為_________。
(3)人體血液中的碳酸和碳酸氫鹽存在平衡:H++ HCO3- H2CO3,當有少量酸性或堿性物質進入血液中時,血液的pH變化不大,用平衡移動原理解釋上述現象。____________________
H2CO3,當有少量酸性或堿性物質進入血液中時,血液的pH變化不大,用平衡移動原理解釋上述現象。____________________
(4)查閱資料獲知如下信息:
i.H2CO3:Ki1=4.3×10-7,Ki2=5.6×10-11(以Ki1為主)
ii.標況下,CO2的溶解度為約為1:1
iii.H2O+CO2  H2CO3
H2CO3 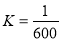
iv. 

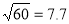 ㏒(6)=0.8
㏒(6)=0.8
請嘗試估算:
①飽和二氧化碳溶液中碳酸的物質的量濃度c(H2CO3)約為_______________mol/L;
②飽和二氧化碳溶液中碳酸的電離度α約為_____________。
③正常雨水的pH約為____________。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年江西省高二上學期期中化學試卷(解析版) 題型:選擇題
以NA代表阿伏加德羅常數的值,則關于熱化學方程式C2H2(g)+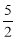 O2(g) →2CO2(g)+H2O(l) ΔH=-1300 kJ·mol-1的說法中,正確的是( )
O2(g) →2CO2(g)+H2O(l) ΔH=-1300 kJ·mol-1的說法中,正確的是( )
A.當10NA個電子轉移時,該反應吸收1300 kJ的能量
B.當1NA個水分子生成且為液體時,吸收1300 kJ的能量
C.當2NA個碳氧共用電子對生成時,放出1300 kJ的能量
D.當8NA個碳氧共用電子對生成時,放出1300 kJ的能量
查看答案和解析>>
科目:高中化學 來源:2016-2017學年湖北省宜昌市高二上期中化學卷(解析版) 題型:選擇題
在密閉容器中發生下列反應aA(g)?cC(g)+dD(g),壓縮容積到原來的一半,當再次達到平衡時,D的濃度為原平衡的1.8倍,下列敘述正確的是( )
A.A的轉化率變大 B.平衡向正反應方向移動
C.D的體積分數變大 D.a<c+d
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com