
【題目】在密閉容器中進行下列反應:M(氣)+N(氣)R(氣)+2L(?)此反應符合下面圖象,下列敘述正確的是( )
A.正反應放熱,L是氣體
B.正反應吸熱,L是固體
C.正反應吸熱,L是氣體
D.正反應放熱,L是固體或液體
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】根據物質的溶解性“相似相溶”的一般規律,說明溴、碘單質在四氯化碳中比在水中溶解度大,下列說法正確的是( )
A. 溴、碘單質和四氯化碳中都含有鹵素
B. 溴、碘是單質,四氯化碳是化合物
C. Cl2、Br2、I2是非極性分子,CCl4也是非極性分子,而水是極性分子
D. 以上說法都不對
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用氮化硅(Si3N4)陶瓷代替金屬制造發動機的耐熱部件,能大幅度提高發動機的熱效率.工業上用化學氣相沉積法制備氮化硅,其反應如下:
3SiCl4(g)+2N2(g)+6H2(g)Si3N4(s)+12HCl(g)△H<0 完成下列填空:
(1)在一定溫度下進行上述反應,若反應容器的容積為2L,3min后達到平衡,測得固體的質量增加了2.80g,則H2的平均反應速率 mol(Lmin)﹣1;該反應的平衡常數表達式K= .
(2)上述反應達到平衡后,下列說法正確的是 .
a.其他條件不變,壓強增大,平衡常數K減小
b.其他條件不變,溫度升高,平衡常數K減小
c.其他條件不變,增大Si3N4物質的量,平衡向左移動
d.其他條件不變,增大HCl物質的量,平衡向左移動
(3)將0.050mol SO2(g)和0.030mol O2(g)放入容積為1L的密閉容器中,反應2SO2(g)+O2(g)2SO3(g)在一定條件下達到平衡,測得c(SO3)=0.040mol/L.計算該條件下反應的平衡常數K和SO2的平衡轉化率(寫出計算過程).
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】臭氧是一種強氧化劑,常用于消毒、滅菌等。
(1)O3與KI溶液反應生成的兩種單質是___________和_________(填分子式)。
(2)O3在水中易分解,一定條件下,O3的濃度減少一半所需的時間(t)如表所示。已知:O3的起始濃度為0.0216 mol/L。
| 3.0 | 4.0 | 5.0 | 6.0 |
20 | 301 | 231 | 169 | 58 |
30 | 158 | 108 | 48 | 15 |
50 | 31 | 26 | 15 | 7 |
①pH增大能加速O3分解,表明對O3分解起催化作用的是___________.。
②在30°C、pH=4.0條件下,O3的分解速率為__________ mol/(L·min)。
③據表中的遞變規律,推測O3在下列條件下分解速率依次增大的順序為______.(填字母代號)
a. 40°C、pH=3.0 b. 10°C、pH=4.0 c. 30°C、pH=7.0
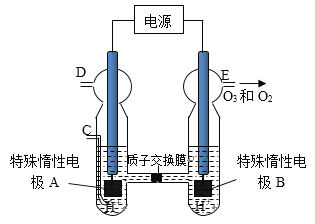
(3)O3 可由臭氧發生器(原理如圖)電解稀硫酸制得。
①圖中陰極為_________(填“A”或“B”),其電極反應式為_________________.
②若C處通入O 2 ,則A極的電極反應式為_____________________.
③若C處不通入O 2 ,D、E處分別收集到xL和有yL氣體(標準狀況),則E處收集的氣體中O 3 所占的體積分數為__________.(忽略O 3 的分解)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ. 砷化鎵為第三代半導體,以其為材料制造的燈泡壽命長.耗能少。已知砷化鎵的晶胞結構如圖所示。請回答下列問題:
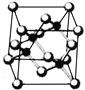
(1)下列說法正確的是__________(填序號)
A.砷化鎵晶胞結構與NaCl相同 B.第一電離能 As>Ga
C.電負性 As>Ga D.原子半徑 As>Ga
(2)砷化鎵可由(CH3)3Ga和AsH3在700℃下反應制得,反應的方程式為_____________________________;
(3)AsH3空間形狀為___________;已知(CH3)3 Ga為非極性分子,則其中鎵原子的雜化方式為____________;
Ⅱ. 金屬銅的導電性僅次于銀,居金屬中的第二位,大量用于電氣工業。
(4)請解釋金屬銅能導電的原因_______________________, Cu2+的核外電子排布式為_______________________。
(5)在硫酸銅溶液中通入過量的氨氣,小心蒸發,最終得到深藍色的[Cu(NH3)4]SO4晶體,晶體中含有的化學鍵除普通共價鍵外,還有_________和_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上用CO生產燃料甲醇。一定溫度和容積條件下發生反應:CO(g)+2H2(g)![]() CH3OH(g)。圖1表示反應中的能量變化;圖2表示一定溫度下,在體積為1L的密閉容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的濃度隨時間變化。
CH3OH(g)。圖1表示反應中的能量變化;圖2表示一定溫度下,在體積為1L的密閉容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的濃度隨時間變化。

請回答下列問題:
(1)在“圖1”中,曲線_______(填“a”或“b”)表示使用了催化劑;沒有使用催化劑時,在該溫度和壓強條件下反應CO(g)+2H2(g)![]() CH3OH(g)的△H=_________。
CH3OH(g)的△H=_________。
(2)從反應開始到建立平衡,v(CO)=________;達到平衡時,該溫度下CO(g)+2H2(g) ![]() CH3OH(g)的化學平衡常數為______________。達到平衡后若保持其它條件不變,將容器體積壓 縮為0.5L,則平衡___________移動 (填“正向”、“逆向”或“不”)。
CH3OH(g)的化學平衡常數為______________。達到平衡后若保持其它條件不變,將容器體積壓 縮為0.5L,則平衡___________移動 (填“正向”、“逆向”或“不”)。
(3)已知CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g);ΔH=-193kJ/mol。又知H2O(l)= H2O(g);ΔH=+44 kJ/mol,請寫出32g的CH3OH(g)完全燃燒生成液態水的熱化學方程式____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.如圖所示,甲、乙兩裝置電極材料都是鐵棒與碳棒,請回答下列問題:
(1)若兩裝置中均為CuSO4溶液,反應一段時間后:
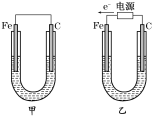
①有紅色物質析出的分別是甲、乙裝置中的________。
A.甲中的Fe棒,乙中的Fe棒 B.甲中的C棒,乙中的Fe棒
C. 甲中的C 棒,乙中的Fe棒 D.甲中的C棒,乙中的C棒
②乙裝置中陽極的電極反應式是:____________________________________________。
(2)若兩裝置中均為飽和NaCl溶液:
①寫出乙裝置中總反應的離子方程式:_________________________________________。
②將濕潤的淀粉KI試紙放在乙裝置碳極附近,發現試紙變藍,解釋其原因:___________。
Ⅱ.如圖為綠色電源“甲烷燃料電池”的工作原理示意圖。
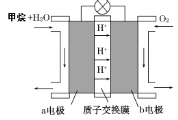
負極的電極反應為______________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖表示不同溫度下水溶液中c(H+)與c(OH-)的關系,下列判斷正確的是( )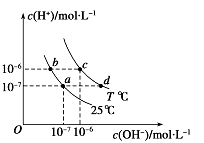
A.只采用升溫的方式,可由a點變成d點
B.T<25
C.b點和c點pH均為6,溶液呈酸性
D.兩條曲線上任意點均有c (H+) ×c (OH-)=Kw
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國預計在2020年前后建成自己的載人空間站,為循環利用人體呼出的CO2并提供氧氣。我國科學家設計了一種裝置(如圖所示),實現“太陽能→電能→化學能”轉化,總反應為2CO2=2CO+O2,下列有關說法不正確的是
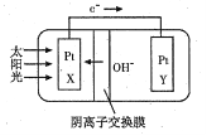
A. 該裝置屬于電解池
B. X極發生氧化反應,Y極發生還原反應
C. 人體呼出的水蒸氣參與Y極反應:CO2+H2O+2e-=CO+2OH-
D. X極每產生標準狀況下22.4L氣體,有2mol的OH-從Y極移向X極
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com