
(8分)(1)白色的Fe(OH)2在空氣中發生的顏色變化為________________________;
(2)寫出硅酸鈉溶液在空氣中變質的化學方程式:____________________________;
(3)寫出用熟石灰吸收氯氣制漂白粉的化學方程式: ;
(4)將CaMg3Si4O12改寫為氧化物的形式:__________________________________。
 奪冠金卷全能練考系列答案
奪冠金卷全能練考系列答案科目:高中化學 來源: 題型:

| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| ||
| 選項 | 陳述Ⅰ | 陳述Ⅱ | 判斷 |
| A | 銅綠的主成分是堿酸銅 | 可用稀鹽酸除銅器表面的銅綠 | Ⅰ對;Ⅱ對;有 |
| B | 銅表易形成致密的氧化膜 | 銅容器可以盛放濃硫酸 | Ⅰ對;Ⅱ對;有 |
| C | 鐵比銅活潑 | 例在銅板上的鐵釘在潮濕空氣中不易生銹 | Ⅰ對;Ⅱ對;有 |
| D | 藍色硫酸銅晶體受熱轉化為白色硫酸銅粉末是物理變化 | 硫酸銅溶液可用作游泳池的消毒劑 | Ⅰ錯;Ⅱ對;無 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解

| 檢驗試劑 | 預期現象與結論 |
| 裝置III的試管中加入足量 0.5mol.L-1BaCl2 0.5mol.L-1BaCl2 . |
產生大量白色沉淀,證明氣體產物中含有SO3. |
| 裝置IV的試管中加入足量 0.01mol.L-1酸性KMnO4溶液(或0.0lmol.L-1溴水) 0.01mol.L-1酸性KMnO4溶液(或0.0lmol.L-1溴水) . |
若溶液紫色(或橙色)褪去,證明氣體產物中含有SO2, 若溶液紫色(或橙色)褪去,證明氣體產物中含有SO2, 若溶液紫色(或橙色)無明顯變化,證明氣體產物中不含SO2 若溶液紫色(或橙色)無明顯變化,證明氣體產物中不含SO2 . |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| 族 周期 |
ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | |||||


| ||
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:
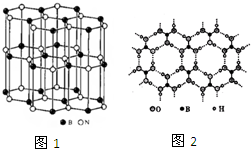 尿素(
尿素(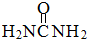 )和硼砂(Na2B4O7)在高溫高壓下反應可以獲得硼氮化合物:
)和硼砂(Na2B4O7)在高溫高壓下反應可以獲得硼氮化合物:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com