
| A. | 加入鋁粉有氫氣生成的溶液中可能大量存在:Ba2+、AlO2-、Cl- | |
| B. | 在含有NH3•H2O的溶液中可能大量共存的離子:Fe3+、HCO3-、NO3- | |
| C. | 亞硫酸的電離:H2SO3═HSO3-+H+ | |
| D. | 向NaHSO4溶液中加入Ba(OH)2溶液呈中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
分析 A.加入鋁粉有氫氣生成的溶液可能呈酸性或堿性;
B.與NH3•H2O反應的離子不能大量共存;
C.亞硫酸為二元弱酸;
D.向NaHSO4溶液中加入Ba(OH)2溶液呈中性,二者按2:1反應.
解答 解:A.加入鋁粉有氫氣生成的溶液可能呈酸性或堿性,堿性條件下可大量共存,故A正確;
B.與NH3•H2O反的Fe3+、HCO3-不能大量共存,故B錯誤;
C.亞硫酸為二元弱酸,電離方程式為H2SO3?HSO3-+H+,故C錯誤;
D.向NaHSO4溶液中加入Ba(OH)2溶液呈中性,二者按2:1反應,應為2H++SO42-+Ba2++OH-═BaSO4↓+2H2O,故D錯誤.
故選A.
點評 本題考查離子反應,為高頻考點,側重于離子共存以及離子方程式的書寫,為高頻考點,注意把握離子的性質以及離子方程式的書寫方法,難度不大.


 超能學典應用題題卡系列答案
超能學典應用題題卡系列答案科目:高中化學 來源: 題型:實驗題
| 實驗步驟 | 預期現象和結論 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在金屬鈉與足量水反應中,增加水的量能加快反應速率 | |
| B. | 工業生產使用催化劑是為了加快反應速率,提高生產效率 | |
| C. | 2SO2+O2?2SO3反應中,SO2的轉化率不能達到100% | |
| D. | 實驗室用碳酸鈣和鹽酸反應制取CO2,用碳酸鈣粉末比塊狀反應要快 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 待提純樣品(括號內為雜質) | 除雜方法或實驗裝置 |
| A | 淀粉膠體(KI溶液) | 過濾 |
| B | 乙酸乙酯(飽和碳酸鈉溶液) | 蒸餾,收集77℃下餾分 |
| C | CO2(SO2) | 通過盛有飽和碳酸鈉溶液的洗氣瓶并干燥 |
| D | 氯氣(氯化氫) | 通過盛有飽和食鹽水的洗氣瓶并干燥 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
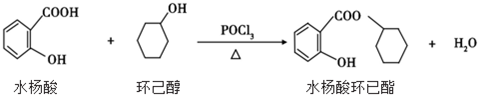
| A. | 水楊酸的核磁共振氫譜有 4 個吸收峰 | |
| B. | 水楊酸、環已醇和水楊酸環已酯都能與 FeCl3 溶液發生顯色反應 | |
| C. | 1mol 水楊酸跟濃溴水反應時,最多消耗 2molBr2 | |
| D. | 1mol 水楊酸環已酯在 NaOH 溶液中水解時,最多消耗 3molNaOH |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 制取Fe(OH)3膠體:Fe3++3H2O $\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+ | |
| B. | 鍋爐除水垢時先用純堿浸泡:CaSO4+CO32-═CaCO3+SO42- | |
| C. | 泡沫滅火器滅火原理:2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑ | |
| D. | 向苯酚鈉溶液中通入少量CO2:2C6H5O-+CO2+H2O═CO32-+2C6H5OH |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 由1mol CH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-數目為NA個 | |
| B. | 常溫常壓下,14g由N2與CO組成的混合氣體含有的原子數目為NA | |
| C. | 用石墨電極電解Cu(NO3)2溶液,當轉移電子數為0.2NA時,陰極析出6.4g金屬 | |
| D. | 常溫下含有NA個NO2、N2O4分子的混合氣體,溫度降至0℃,其體積約為22.4L |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com