
目前世界上60%的鎂是從海水中提取的。海水提鎂的主要流程如下: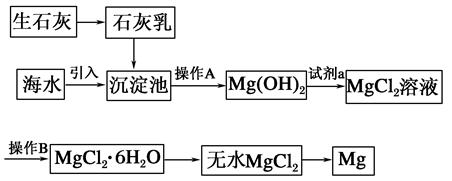
請回答下列問題:
(1)從離子反應的角度思考,在海水中加入石灰乳的作用是________,寫出在沉淀池中發生反應的離子方程式:_________________________________________________。
(2)石灰乳是生石灰與水形成的化合物,從充分利用海洋化學資源,提高經濟效益的角度考慮,生產生石灰的主要原料來源于海洋中的________。
(3)操作A是________,操作B是________。
(4)加入的足量試劑a是________(填化學式)。
(5)無水MgCl2在熔融狀態下,通電后會產生Mg和Cl2,該反應的化學方程式為________,從考慮成本和廢物循環利用的角度,副產物氯氣可以用于________。
 小學教材全測系列答案
小學教材全測系列答案 小學數學口算題卡脫口而出系列答案
小學數學口算題卡脫口而出系列答案 優秀生應用題卡口算天天練系列答案
優秀生應用題卡口算天天練系列答案 浙江之星課時優化作業系列答案
浙江之星課時優化作業系列答案科目:高中化學 來源: 題型:填空題
1862年,比利時化學家索爾維發明了氨堿法制堿,1926年,我國化學家侯德榜創立了
更為進侯德榜制堿法,也叫聯合制堿法,兩種制堿的生產流程可簡要表示如下圖: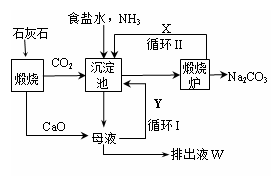

氨堿法生產流程 聯合制堿法生產流程
(1)向沉淀池中通入CO2和氨氣時,應先通入氨氣的原因是 。
(2)沉淀池中發生反應的化學反應方程式是 從沉淀池中分離沉淀的操作是 。
(3)氨堿法生產流程示意圖中的Y是 ,從原料到產品,氨堿法總反應過程用化學方程式表示,可寫為 。
(4)聯合制堿法中從濾液中提取氯化銨晶體的過程推測,所得結論正確是 (選填編號)。
a.常溫時氯化銨的溶解度比氯化鈉小
b.通入氨氣能增大NH4+的濃度,使氯化銨更多析出
c.加入食鹽細粉能提高Na+的濃度, 使NaHCO3結晶析出
d.通入氨氣能使NaHCO3轉化為Na2CO3,提高析出的NH4Cl純度
(5)聯合制堿法相比于氨堿法,氯化鈉利用率從70%提高到90%以上,主要是設計了循環Ⅰ,聯合制堿法的另一項優點是 。
(6)產品純堿中含有碳酸氫鈉,可以用加熱分解的方法測定產品中純堿的質量分數,已知樣品質量為ag,加熱至質量不再改變時稱重為bg,則純堿的質量分數為 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
蘇打和小蘇打有著廣泛的應用。試從反應物用量角度說明在下列用途中選A(蘇打)還是B(小蘇打),并說明原因。
(1)做面條時防止面粉較長時間儲存變酸味,常加入適量的面堿,選用______,因為______________________________
(2)作為泡沫滅火器的藥品,選用________,因為________________________
(3)用于洗滌餐具及實驗室的玻璃儀器等,選用________,因為_____________
(4)治療胃酸過多時,選用________,因為_______________________________
(提示:二者水溶液均顯堿性,且蘇打的堿性強)
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
A、B、C、X均為中學常見的純凈物,它們之間有如圖轉化關系(副產物已略去)。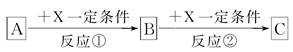
回答下列問題:
(1)若X是強氧化性單質,則A不可能是________。
a.S b.N2 c.Na d.Mg e.Al
(2)若A、B、C為含金屬元素的無機化合物,X為強電解質溶液,A溶液與C溶液反應生成B,則B的化學式為________,X的化學式可能為(寫出不同類物質)________或________,反應①的離子方程式為________________________或________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
科研、生產中常涉及鐵及其化合物
(1)實驗室配制FeSO4溶液時,常向溶液中加入的物質有__________________。
(2)高鐵酸鹽在能源、環保等方面有著廣泛的用途,高鐵酸鉀(K2FeO4)是一種理想的水處理劑,處理水時所起的作用是________________________。
(3)高鐵電池是一種新型可充電、能長時間保持穩定放電電壓的電池。該電池總反應式為3Zn(OH)2+2Fe(OH)3+4KOH 3Zn+2K2FeO4+8H2O,該電池放電時的負極反應式為________,充電時陽極附近溶液的pH________(填“變大”、“不變”或“變小”)。
3Zn+2K2FeO4+8H2O,該電池放電時的負極反應式為________,充電時陽極附近溶液的pH________(填“變大”、“不變”或“變小”)。
(4)高爐煉鐵過程中發生下列反應:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-24.8 kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH=-47.2 kJ/mol
③3Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+640.4 kJ/mol
請你寫出用CO還原FeO固體制得Fe和CO2的熱化學方程式:________________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
明礬石是制取鉀肥和氫氧化鋁的重要原料,明礬石的組成和明礬相似,此外還含有氧化鋁和少量氧化鐵雜質。具體實驗步驟如下圖所示:
根據上述圖示,完成下列填空:
(1)明礬石焙燒后用稀氨水浸出。配制500mL稀氨水(每升含有39.20g氨)需要取濃氨水(每升含有251.28g氨)__________mL,用規格為_______mL量筒量取。
(2)氨水浸出后得到固體混合體系,過濾,濾液中除K+、SO42-外,還有大量的NH4+。檢驗NH4+的方法是______________________________________________。
(3)寫出沉淀物中所有物質的化學式________________________________________。
(4)濾液I的成分是水和______________。
(5)為測定混合肥料K2SO4、(NH4)2SO4中鉀的含量,請完善下列步驟:
①稱取鉀氮肥試樣并溶于水,加入足量______溶液,產生白色沉淀。
②___________、__________、_________(依次填寫實驗操作名稱)。
③冷卻、稱重。
(6)若試樣為mg,沉淀的物質的量為nmol,則試樣中K2SO4的物質的量為:___________mol(用含有m、n的代數式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(NH4)2Fe(SO4)2·6H2O俗名摩爾鹽,價格便宜,可用來凈水或治療缺鐵性貧血等,是一種重要的化工原料。
(1)摩爾鹽的水溶液呈 色。
(2)c(Fe2+)相同的摩爾鹽和硫酸亞鐵兩溶液比較,物質的量濃度較大的是 。
(3)甲乙兩位同學想測定一瓶摩爾鹽的純度。甲同學設計的實驗裝置如圖1:
從上圖推斷甲同學想通過測定 計算摩爾鹽的純度。該方案的不足之處在于 。
(4)乙同學在甲同學的基礎上做了改進,其實驗裝置如圖2: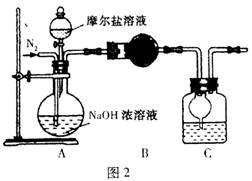
則B與C中的試劑分別是 和 。C中干燥管的作用是 。乙同學稱取了10.0g的摩爾鹽樣品,若實驗完畢后測得洗氣瓶及瓶內溶液共增重O.68 g,則依此數據推算這份摩爾鹽的純度為 %(答案精確到小數點后第一位)。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
氫能源是一種重要的清潔能源。現有兩種可產生H2的化合物甲和乙。將6.00 g甲加熱至完全分解,只得到一種短周期元素的金屬單質和6.72 L的H2(已折算成標準狀況)。甲與水反應也能放出H2,同時還產生一種白色沉淀物,該白色沉淀可溶于NaOH溶液。化合物乙在催化劑存在下可分解得到H2和另一種單質氣體丙,丙在標準狀況下的密度為1.25 g·L-1請回答下列問題:
(1)甲的化學式是________;乙的電子式是________。
(2)甲與水反應的化學方程式是________。
(3)氣體丙與金屬鎂反應的產物是________(用化學式表示)。
(4)乙在加熱條件下與CuO反應可生成Cu和氣體丙,寫出該反應的化學方程式__________________。有人提出產物Cu中可能還混有Cu2O,請設計實驗方案驗證之______________________。
(已知:Cu2O+2H+=Cu+Cu2++H2O)
(5)甲與乙之間________(填“可能”或“不可能”)發生反應產生H2,判斷理由是________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
有關物質間轉化關系如下圖,試回答:
(1)轉化①的反應條件為 .
(2)轉化②的化學方程式為 .轉化③的離子方程式為 .
(3)若轉化⑤用于實驗室制Al(OH)3,則試劑A宜選擇 (填名稱).
(4)向50 mL 3 mol·L-1 AlCl3溶液中滴加1 mol·L-1 NaOH溶液,結果Al3+離子有1/3轉化為Al(OH) 3沉淀,則加入的NaOH溶液的體積可能為 或 mL。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com