
【題目】儲氫納米碳管的研制成功體現了科技的進步。用電弧法合成的碳納米管常伴有大量的雜質——碳納米顆粒。這種碳納米顆粒可用氧化氣化法提純。其反應中的反應物和生成物有C、CO2、H2SO4、K2Cr2O7、K2SO4、Cr2(SO4)3和H2O七種。
(1)請用上述物質填空(不用配平):C+________+H2SO4——________+______+Cr2(SO4)3+H2O。
(2)上述反應中氧化劑是(填化學式)________,被氧化的元素是(填元素符號)________。
(3)H2SO4在上述反應中表現出來的性質是(填選項序號)________。
A.氧化性 B.氧化性和酸性 C.酸性 D.還原性和酸性
(4)若反應中電子轉移了0.8 mol,則產生的氣體在標準狀況下的體積為________。
【答案】K2Cr2O7 CO2 K2SO4 K2Cr2O7 C C 4.48 L
【解析】
(1)由C→CO2、K2Cr2O7→Cr2(SO4)3可知,碳元素的化合價從0價升高到+4價,失去4個電子。Cr元素的化合價從+6價降低到+3價,得到3個電子,所以根據電子得失守恒可知還原劑與氧化劑的物質的量之比是3:2。根據原子守恒可知,反應中還有硫酸鉀生成,則反應的化學方程式為3C+2K2Cr2O7+8H2SO4=3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O。
(2)根據(1)可知氧化劑為K2Cr2O7,還原產物為Cr2(SO4)3,還原劑為C,氧化產物為CO2,被氧化的元素是C。
(3)H2SO4在反應中各元素的化合價沒有發生變化,但反應中有硫酸鹽生成,所以硫酸只表現酸性,答案選B。
(4)設產生的氣體的體積為V,根據反應式計算:
3C+2K2Cr2O7+8H2SO4=3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O轉移電子
33.6L 12mol
V 0.8mol
解得V=![]() =4.48L。
=4.48L。


 心算口算巧算一課一練系列答案
心算口算巧算一課一練系列答案 應用題作業本系列答案
應用題作業本系列答案科目:高中化學 來源: 題型:
【題目】A、B、C、D是四種短周期元素,E是過渡元素。A、B、C同周期,C、D同主族,A的原子結構示意圖為:![]() ,B是同周期第一電離能最小的元素,C的最外層有三個成單電子,E是生活中最堅硬的金屬。回答下列問題:
,B是同周期第一電離能最小的元素,C的最外層有三個成單電子,E是生活中最堅硬的金屬。回答下列問題:
(1)用元素符號表示D所在周期(除稀有氣體元素外)電負性最大的元素是__;
(2)D的氫化物比C的氫化物的沸點__(填"高"或"低"),原因__;
(3)寫出E元素的電子排布式__,已知元素周期表可按電子排布分為s區、p區等,則E元素在__區;
(4)A、B、C最高價氧化物的晶體類型是分別是___晶體,__晶體,__晶體;
(5)畫出D的核外電子排布圖___,這樣排布遵循了__原理和___規則。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙烯是重要有機化工原料。結合以下路線回答:
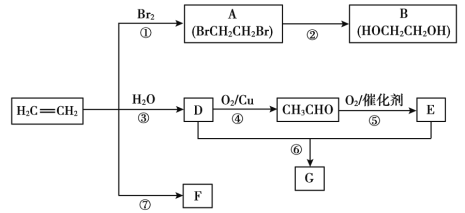
已知:2CH3CHO+O2![]() 2CH3COOH
2CH3COOH
(1)反應①的化學方程式是__。
(2)B的官能團是__。
(3)F是一種高分子,可用于制作食品袋,其結構簡式為__。
(4)G是一種油狀、有香味的物質,有以下兩種制法。
制法一:實驗室用D和E反應制取G,某學習小組在實驗室制取乙酸乙酯的主要步驟如下:
i.配制2mL濃硫酸、3mLD(含18O)和2mLE的混合溶液。
ii.按如圖連接好裝置并加入混合液,用小火均勻加熱3~5min。
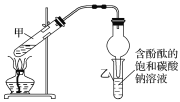
iii.待試管乙收集到一定量產物后停止加熱,撤出試管乙用力振蕩,然后靜置待分層。
iv.分離出乙酸乙酯,洗滌、干燥。
回答問題:
①裝置中球形干燥管,除起冷凝作用外,另一重要作用是___。
②步驟②安裝好實驗裝置,加入藥品前還應檢查__。
③反應中濃硫酸的作用是__;寫出能表示18O位置的制取乙酸乙酯的化學方程式:__。
④上述實驗中飽和碳酸鈉溶液的作用是__(填字母)。
a.中和乙酸并吸收乙醇
b.中和乙酸和乙醇
c.降低乙酸乙酯的溶解度
d.加速酯的生成,提高其產率
⑤步驟③所觀察到的現象是__;從試管乙中分離出乙酸乙酯的實驗操作名稱是___。
制法二:工業上用CH2=CH2和E直接反應獲得G。
a.反應類型是__。
b.與制法一相比,制法二的優點是__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用于凈化汽車尾氣的反應:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g),已知該反應速率極慢,570K時平衡常數為1×1059。下列說法正確的是
2CO2(g)+N2(g),已知該反應速率極慢,570K時平衡常數為1×1059。下列說法正確的是
A.裝有尾氣凈化裝置的汽車排出的氣體中一定不再含有NO或CO
B.提高尾氣凈化效率的常用方法是升高溫度
C.提高尾氣凈化效率的最佳途徑是研制高效催化劑
D.570K時該反應正向進行的程度很大,故使用催化劑并無實際意義
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】消除含氮化合物對大氣和水體的污染是環境保護的重要研究課題。
(1)已知反應8NH3+6NO2=7N2+12H2O,請分析氧化產物和還原產物的質量之比為________。
(2)水體中過量氨氮(以NH3表示)會導致水體富營養化。
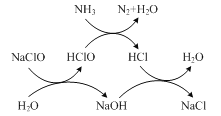
①用次氯酸鈉除去氨氮的原理如題圖所示。寫出該圖示的總反應化學方程式:________。
該反應需控制溫度,溫度過高時氨氮去除率降低的原因是________。
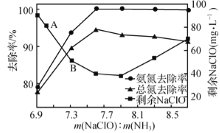
②取一定量的含氨氮廢水,改變加入次氯酸鈉用量,反應一段時間后,溶液中氨氮去除率、總氮(溶液中所有可溶性的含氮化合物中氮元素的總量)去除率以及剩余次氯酸鈉的含量隨m(NaCIO)m(NH3)的變化情況如圖所示。當m( NaCIO):m(NH3)>7.6時,水體中總氮去除率反而下降,可能的原因是________ 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,用0.02mol/L的NaOH溶液,分別滴定濃度為0.0lmol/L的三種稀酸溶液,滴定的曲線如右圖所示,下列判斷正確的是

A. 三種酸均為弱酸,且同濃度的稀酸中導電性:HA<HB<HD
B. 滴定至P點時,溶液中:c(HB)>c(B-)
C. 溶液呈中性時,三種溶液中:c(A-)>c(B-)>c(D-)
D. 當中和百分數達100%時,將三種溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-2c(H+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用反應6NO2+8NH3= 7N2+12H2O構成電池的裝置如圖所示。此方法既能實現有效清除氮氧化物的排放,減輕環境污染,又能充分利用化學能。下列說法正確的是:

A.電流從左側A電極經過負載后流向右側B電極
B.當有4.48 L NO2被處理時,轉移電子數為0.8NA
C.電極A極反應式為2NH3-6e-= N2+6H+
D.為使電池持續放電,離子交換膜需選用陰離子交換膜
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用NA表示阿伏加德羅常數的值,下列敘述中正確的是( )
A.同溫同壓條件下,等質量的氧氣和臭氧體積比為2∶3
B.33.6 L NH3氣體所含分子的物質的量為1.5 mol
C.常溫常壓下,22 g CO2所含有的分子數為0.5NA
D.標準狀況下,11.2 L水中含有的分子數為0.5NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】四種短周期主族元素 X、Y、Z、W 的相對位置如表,元素 X 的原子核外電子數是 Z的 2 倍。下列說法不正確的是
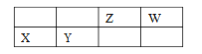
A. W 元素的簡單氣態氫化物的熱穩定性比 Z 元素的簡 單氣態氫化物的高
B. 氣體分子(ZW)2 的結構式為 N≡C—C≡N
C. X、Y、W 三種元素的簡單離子半徑最大的是 Y
D. 元素 X 位于周期表中第三周期、第ⅡA族,其單質制備可用電解熔融 XCl2 的方法。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com