
| 氟 | 氯 | 溴 | 碘 | 鈹 | |
| 第一電離能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
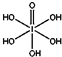 )和HIO4,前者為五元酸,后者為一元酸.請比較二者酸性強弱:H5IO6<HIO4(填“>”、“<”或“=”)
)和HIO4,前者為五元酸,后者為一元酸.請比較二者酸性強弱:H5IO6<HIO4(填“>”、“<”或“=”)
分析 (1)鹵族元素位于周期表中ⅦA族,屬于p區元素;溴處于第四周期ⅦA族;
(2)F元素電負性很大,HF分子之間存在氫鍵;
(3)第一電離能是指原子失去一個電子所需的能量,第一電離能越小,就越容易失去一個電子;
(4)含氧酸中,含非羥基氧原子個數越多,酸性越強(或者同種元素含氧酸中心元素化合價越高,酸性越強);
(5)已知ClO2-為角型,中心氯原子周圍有四對價層電子,則Cl原子雜化軌道數目為4;
原子總數相等、價電子總數也相等的微粒互為等電子體;
(6)碘為分子晶體,晶胞中碘分子的排列有2種不同的取向,在頂點和面心不同,層內以4配位數交替配位形成層結構,分子內I原子之間形成非極性鍵,而分子之間為范德華力,根據均攤法計算晶胞中I原子數目;
(7)根據均攤法可知晶胞中紅色球數目為4、黃色球數目為8,結合化學式可知黃色球為Ca2+、黃色球為F-,假設CaF2的相對分子質量為M,表示出晶胞質量,兩個離得最近的鈣離子是位于頂點和面心上的,則晶胞面對角線長度為2a c,故晶胞棱長為2a cm×$\frac{\sqrt{2}}{2}$=$\sqrt{2}a$ cm,再結合m=ρV計算.
解答 解:(1)鹵族元素位于周期表中ⅦA族,屬于p區元素;溴處于第四周期ⅦA族,價電子排布式為4s24p5,
故答案為:p;4s24p5;
(2)F元素電負性很大,HF分子之間存在氫鍵,時氫氟酸以二分子締合(HF)2形式存在,
故答案為:氫鍵;
(3)碘的第一電離能越小,碘更容易形成較穩定的單核陽離子,
故答案為:碘;
(4)H5IO6(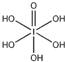 )中含有5個羥基氫,為五元酸,含非羥基氧原子1個,HIO4為一元酸,含有1個羥基氫,含非羥基氧原子3個,所以酸性:H5IO6<HIO4,
)中含有5個羥基氫,為五元酸,含非羥基氧原子1個,HIO4為一元酸,含有1個羥基氫,含非羥基氧原子3個,所以酸性:H5IO6<HIO4,
故答案為:<;
(5)已知ClO2-為角型,中心氯原子周圍有四對價層電子,則Cl原子雜化軌道數目為4,屬于sp3雜化;等電子體具有相同的電子數目和原子數目的微粒,與CN-互為等電子體的為N2或 CO等,
故答案為:sp3;N2或 CO;
(6)A.碘分子的排列有2種不同的取向,在頂點和面心不同,層內2種取向不同的碘分子以4配位數交替配位形成層結構,故A正確;
B.用均攤法可知平均每個晶胞中碘分子數目為8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,即有8個碘原子,故B錯誤;
C.碘晶體為無限延伸的空間結構,構成微粒為分子,是分子晶體,故C錯誤;
D.分子內I原子之間形成非極性鍵,而分子之間為范德華力,故D正確;
故答案為:AD;
(7)根據均攤法可知晶胞中紅色球數目為8×$\frac{1}{8}$+6×$\frac{1}{2}$=4、黃色球數目為8,結合化學式可知黃色球為Ca2+、黃色球為F-,假設CaF2的相對分子質量為M,則晶胞質量為4×$\frac{M}{{N}_{A}}$g,兩個離得最近的鈣離子是位于頂點和面心上的,則晶胞面對角線長度為2a c,故晶胞棱長為2a cm×$\frac{\sqrt{2}}{2}$=$\sqrt{2}a$ cm,則4×$\frac{M}{{N}_{A}}$g=ρg/cm3($\sqrt{2}a$ cm)3,解得M=$\frac{\sqrt{2}}{2}$ρNAa3,
故答案為:$\frac{\sqrt{2}}{2}$ρNAa3.
點評 本題是對物質結構與性質的考查,涉及核外電子排布、氫鍵、電離能、分子結構與性質、雜化方式、等電子體、晶胞結構與計算等知識點,需要學生具備扎實的基礎與靈活運用能力,需要學生具備一定的空間想象與數學計算能力.


科目:高中化學 來源: 題型:選擇題
| A. | 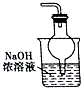 用如圖裝置除去乙酸乙酯中混有的少量乙酸 | |
| B. | 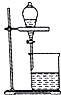 用如圖裝置可直接分離溴苯和溴 | |
| C. | 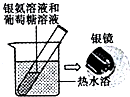 用如圖裝置驗證葡萄糖分子有還原性 | |
| D. | 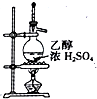 用如圖裝置制取乙烯 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 碘是人體必需微量元素,所以要多吃富含高碘酸的食物 | |
| B. | “霾塵積聚難見路人”,霧霾所形成的氣溶膠有丁達爾效應 | |
| C. | 藥皂中含有苯酚,能殺菌消毒,故苯酚具有強氧化性 | |
| D. | 屠呦呦獲得了2015年諾貝爾獎,她用乙醚提取青蒿素的過程屬于化學變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 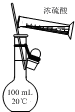 用如圖裝置配制100 mL 0.1 mol/L的硫酸 | |
| B. |  用如圖裝置提取碘水中碘 | |
| C. |  用如圖裝置制取少量乙烯氣體 | |
| D. | 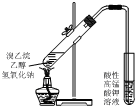 用如圖裝置驗證溴乙烷發生消去反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 150mL 1mol/L 的NaCl溶液 | B. | 75mL 2mol/L的NH4Cl溶液 | ||
| C. | 100mL 1.5mol/L的KCl溶液 | D. | 75mL 1.5mol/L的CaCl2溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
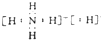 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子半徑由大到小的順序:Z、W、Y | |
| B. | 簡單氣態氫化物的穩定性由強到弱的順序:X、Y、R | |
| C. | W的最高價氧化物對應的水化物堿性比Z的強 | |
| D. | R的最高價氧化物對應的水化物化學式一定是HRO4 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
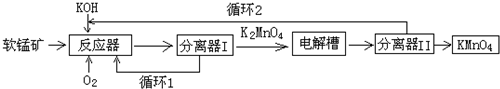
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 中和滴定盛待測液的錐形瓶中有少量水對滴定結果無影響,錐形瓶不能用待測液潤洗 | |
| B. | 酸式和堿式滴定管用蒸餾水洗凈后還需用標準液或待測液潤洗 | |
| C. | 滴定時左手控制滴定管活塞,右手握持錐形瓶,邊滴邊振蕩,眼睛注視滴定管的液面 | |
| D. | 稱量氯化鈉固體,氯化鈉放在稱量紙上,置于托盤天平的左盤,砝碼放在天平的右盤 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com