
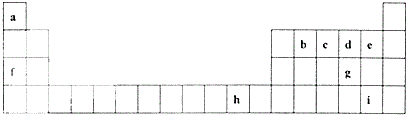
 下表是元素周期表的一部分,表中所列的字母分別代表一種化學元素.
下表是元素周期表的一部分,表中所列的字母分別代表一種化學元素. .
.
分析 根據元素在周期表中位置可知,a為H,b為C,c為N,d為O,e為F,f為Na,g為S,h為Cu,i為Br,
(1)氧元素位P區,是8號元素,據此畫電子排布圖;
(2)C2H2中C、H之間有一個單鍵,C、C之間為參鍵,其中一個是σ鍵,兩個是π鍵;
(3)b、c、d形成的雙核粒子為CO、NO、N2、O2、CN-、C22-,等電子體為價電子數和原子數都相等的微粒,據此判斷,N原子的最外層P軌道處于半滿狀態,是一種穩定結構;
(4)二氣化碳是非極性分子,二氧化硫是極性分子,根據相似相溶原理判斷溶解性,根據二氧化硫中硫原子的價層電子對數判斷硫原子的雜化方式及分子的VSPR模型;
(5)根據晶格能大小可以判斷NaCl和NaF的熔點高低;
(6)根據空間利用率=$\frac{晶胞中所含原子總體積}{晶胞體積}$×100%進行計算.
解答 解:根據元素在周期表中位置可知,a為H,b為C,c為N,d為O,e為F,f為Na,g為S,h為Cu,i為Br,
(1)氧元素位P區,是8號元素,電子排布圖為 ,故答案為:p;
,故答案為:p; ;
;
(2)C2H2中C、H之間有一個單鍵,C、C之間為參鍵,其中一個是σ鍵,兩個是π鍵,所以C2H2中σ鍵與π鍵的數目之比為3:2,
故答案為:3:2;
(3)等電子體為價電子數和原子數都相等的微粒,b、c、d形成的雙核粒子為CO、NO、N2、O2、CN-、C22-,其中互為等電子體的是CO、N2、CN-、C22-,N原子的最外層P軌道處于半滿狀態,是一種穩定結構,失去一個電子所需能量更多,所以N第一電離能大于O,
故答案為:CO、N2、CN-、C22-;N原子的最外層P軌道處于半滿狀態,是一種穩定結構,失去一個電子所需能量更多;
(4)二氣化碳是非極性分子,二氧化硫是極性分子,水為極性分子,所以二氧化硫在水中的溶解性更大,二氧化硫分子中硫原子的價層電子對數為$\frac{6+0}{2}$=3,所以硫原子的雜化方式為sp2,分子的VSPR模型為平面三角形,
故答案為:SO2;sp2;平面三角形;
(5)由于NaF的晶格能大于NaCl,所以NaF的熔點高于NaCl,故答案為:NaF;NaF的晶格能大于NaCl;
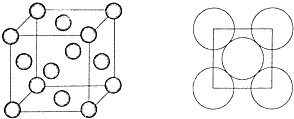
(6)銅的晶胞中含有銅原子數為8×$\frac{1}{8}$$+6×\frac{1}{2}$=4,其中銅原子半徑為r,則銅原子體積為$\frac{4}{3}π{r}^{3}$,根據晶胞的結構圖,晶胞的面對角線的長度為4r,所以晶胞的邊長為$2\sqrt{2}$r,所以晶胞的體積為($2\sqrt{2}r$)3,所以銅晶胞中原子空間利用率=$\frac{晶胞中所含原子總體積}{晶胞體積}$×100%=$\frac{4×\frac{4}{3}π{r}^{3}}{({2\sqrt{2}r)}^{3}}$×100%=$\frac{\sqrt{2}π}{6}$,
故答案為:$\frac{\sqrt{2}π}{6}$.
點評 本題是對物質結構的考查,涉及元素周期表、等電子體、電離能、雜化軌道、核外電子排布、晶胞計算、晶體的性質等,比較全面考查物質結構主干知識,需要學生具備扎實的基礎,晶胞計算為易錯點,注意掌握同周期中第一電離能異常原因,難度較大.


 華東師大版一課一練系列答案
華東師大版一課一練系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 熱化學方程式 | 平衡常數 | |
| 500℃ | 700℃ | |
| ①2H2(g)+CO(g)?CH3OH(g)△H1=a kJ•mol-1 | 2.5 | 0.2 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g)△H2=b kJ•mol-1 | 1.0 | 2.3 |
| ③3H2(g)+CO2 (g)?CH3OH(g)+H2O(g)△H3=c kJ•mol-1 | K3 | 4.6 |

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | C2H4 | B. | C3H6 | C. | C2H6 | D. | C4H8 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
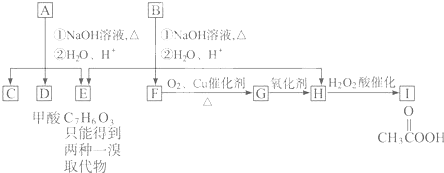
 A經①②兩步反應得C、D和E.B經①②兩步反應得E、F和H.上述反應過程、產物性質及相互關系如下圖所示.
A經①②兩步反應得C、D和E.B經①②兩步反應得E、F和H.上述反應過程、產物性質及相互關系如下圖所示.
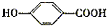 .
. 或
或 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
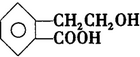 ,它可通過不同化學反應分別制得B、C、D 和E四種物質.
,它可通過不同化學反應分別制得B、C、D 和E四種物質.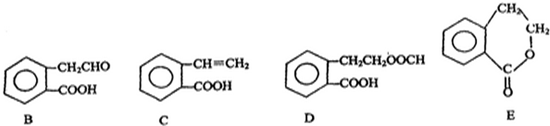
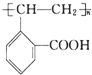 .
. +H2O.
+H2O.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 沉淀H為Al(OH)3、BaCO3的混合物 | |
| B. | 根據上述連續實驗不能確定溶液X中是否含有Fe3+、Cl- | |
| C. | 溶液X中一定含有Al3+、NH4+、Fe2+、SO42-、H+ | |
| D. | 若溶液X為100 mL,產生的氣體A為44.8 mL(標況),則X中c(Fe2+)=0.06 mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com