
A、B、C、D、E、F為前四周期的元素。其中,A元素和B元素的原子都有一個未成對電子,A3+比B-少一個電子層,B原子得一個電子后3p軌道全充滿;C原子的p軌道中有3個未成對電子,其氣態氫化物在水中的溶解性在同族元素所形成的氫化物中最大;D的最高化合價與最低化合價代數和為4,其最高價氧化物對應的水化物可以用于制取炸藥和制作鉛蓄電池;E元素的基態原子核外有六種運動狀態的電子;F元素的單質為紫紅色固體,可通過“濕法冶金”而得。請回答下列問題:
(1)CB3分子中心原子的雜化類型是 。
(2)F元素的原子的外圍電子排布式為 ;如圖所示為F與Au以3∶1形成的合金晶胞圖,在圖中的括號內寫出對應的元素符號。

(3)B、D元素最高價氧化物對應的水化物的酸性強弱: > (填化學式)。
(4)用導線將A和F的單質做成的電極連接起來,插入到盛有C的最高價氧化物的水化物的濃溶液中構成原電池,試寫出在單質A表面發生反應的電極反應式:_____。
(5)分子R是由C元素與氫元素形成的18電子分子,R的電子式為 。
(6)24 g E的單質在33.6 L氧氣(標準狀況)中燃燒,至反應物全部耗盡,放出x kJ熱量。則1mol E與O2反應生成E的低價氧化物時的熱化學方程式為 (已知:E的燃燒熱為y kJ/mol)。
(14分)(1)sp3(2分) (2)3d104s1(2分) (2分)
(2分)
(3)HClO4>H2SO4 (2分);(4)2H++NO3-+e-=NO2↑+H2O(2分)
(5)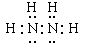 (2分) (6)C(s)+1/2O2(g)=CO(g) △H=-(x-y)kJ/mol(2分)
(2分) (6)C(s)+1/2O2(g)=CO(g) △H=-(x-y)kJ/mol(2分)
【解析】
試題分析:A、B、C、D、E、F為前四周期的元素。其中,A元素和B元素的原子都有一個未成對電子,A3+比B-少一個電子層,B原子得一個電子后3p軌道全充滿,所以B是氯元素,則A是Al;C原子的p軌道中有3個未成對電子,因此C是第ⅤA族元素。其氣態氫化物在水中的溶解性在同族元素所形成的氫化物中最大,所以C是氮元素;D的最高化合價與最低化合價代數和為4,則D是第ⅥA族元素。其最高價氧化物對應的水化物可以用于制取炸藥和制作鉛蓄電池,因此D是S元素;E元素的基態原子核外有六種運動狀態的電子,所以E是碳元素;F元素的單質為紫紅色固體,可通過“濕法冶金”而得,則F是銅。
(1)CB3分子是NCl3,中心原子N原子含有的孤對電子對數=(5-3×1)÷2=1,雜化軌道數目為4,為三角錐型,N原子采取sp3雜化。
(2)銅元素的原子序數是29,則根據構造原理和洪特規則可知,銅原子的外圍電子排布式為3d104s1;根據晶胞結構并依據均攤法可知,黑球個數=8× =1個。白球個數=6×
=1個。白球個數=6× =3個,所以白球和黑球的個數之比是3:1,因此黑球是Au,白球是Cu。
=3個,所以白球和黑球的個數之比是3:1,因此黑球是Au,白球是Cu。
(3)非金屬性越強,最高價氧化物的水化物的酸性越強。氯元素的非金屬性強于硫元素的非金屬性,所以最高價氧化物的水化物的酸性強弱順序是HClO4>H2SO4。
(4)由于常溫下單質鋁在濃硝酸中發生鈍化,所以在該原電池中銅是負極,失去電子。鋁是正極,溶液中的NO3-得到電子,則正極電極反應式是2H++NO3-+e-=NO2↑+H2O。
(5)N和H元素形成的18電子分子是N2H4,其電子式是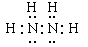 。
。
(6)24g碳的物質的量為24g÷12g/mol=2mol。標準狀況下的33.6L氧氣的物質的量為33.6L÷22.4L/mol=1.5mol。所以n(C):n(O)=2mol:1.5mol×2=1:1.5,故燃燒生成物為CO、CO2.令CO、CO2的物質的量分別為xmol、ymol,根據C原子守恒有x+y=2,根據O原子守恒有x+2y=1.5mol×2,聯立方程,解得x=1,y=1。碳的燃燒熱為ykJ/mol,故生成1molCO2放出的熱量為ykJ,所以生成1molCO放出的熱量為xkJ-ykJ=(x-y)kJ,則1mol碳燃燒生成CO放出的熱量為(x-y)kJ。因此1mol碳與O2反應生成CO時的熱化學方程式為C(s)+1/2O2(g)=CO(g) △H=-(x-y)kJ/mol。
考點:考查元素周期表的結構、元素周期律的應用;雜化軌道、核外電子排布、晶體結構、電子式;原電池原理以及熱化學方程式的書寫等


 同步練習河南大學出版社系列答案
同步練習河南大學出版社系列答案 同步練習西南師范大學出版社系列答案
同步練習西南師范大學出版社系列答案 補充習題江蘇系列答案
補充習題江蘇系列答案 學練快車道口算心算速算天天練系列答案
學練快車道口算心算速算天天練系列答案科目:高中化學 來源: 題型:閱讀理解
| 氟化物 | X | Y | Z |
| 熔點/K | 1266 | 1534 | 183 |
查看答案和解析>>
科目:高中化學 來源: 題型:
 [化學/選修/物質結構與性質]A、B、C、D、E五種短周期元素,原子序數依次增大,各元素對應的單質均為固體.A、C、E三元素的原子核外均只有2個未成對電子.B、E元素的原子序數之和等于C、D元素的原子序數之和.
[化學/選修/物質結構與性質]A、B、C、D、E五種短周期元素,原子序數依次增大,各元素對應的單質均為固體.A、C、E三元素的原子核外均只有2個未成對電子.B、E元素的原子序數之和等于C、D元素的原子序數之和.查看答案和解析>>
科目:高中化學 來源: 題型:
| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解

查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com