
【題目】請寫出下述過程各步的反應類型及化學方程式。
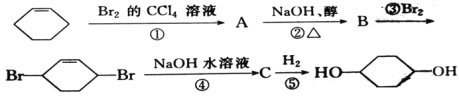
①為_____反應,化學方程式為________
②為_____反應,化學方程式為________
③為_____反應,化學方程式為________
④為_____反應,化學方程式為________
【答案】加成 ![]() + Br2→
+ Br2→![]() 消去
消去 ![]() + 2NaOH
+ 2NaOH![]()
![]() + 2NaBr +2H2O 加成
+ 2NaBr +2H2O 加成 ![]() + Br2→
+ Br2→![]() 水解(或取代)
水解(或取代) ![]() + 2NaOH
+ 2NaOH![]()
![]() + 2NaBr
+ 2NaBr
【解析】
環戊烯與溴加成生成A,A為![]() ,
,![]() 在氫氧化鈉醇溶液中發生消去反應生成B。B為
在氫氧化鈉醇溶液中發生消去反應生成B。B為![]() ,
,![]() 與溴發生1,4-加成反應生成
與溴發生1,4-加成反應生成![]() ,
,![]() 在氫氧化鈉水溶液中發生水解反應生成C,C為
在氫氧化鈉水溶液中發生水解反應生成C,C為![]() ,
,![]() 與氫氣加成生成
與氫氣加成生成![]() ,據此分析解答。
,據此分析解答。
①為環戊烯與溴的加成反應,化學方程式為![]() + Br2→
+ Br2→![]() ,②為
,②為![]() 在氫氧化鈉醇溶液中發生消去反應,化學方程式為
在氫氧化鈉醇溶液中發生消去反應,化學方程式為![]() + 2NaOH
+ 2NaOH![]()
![]() +2NaBr +2H2O,③為
+2NaBr +2H2O,③為![]() 與溴發生1,4-加成反應,化學方程式為
與溴發生1,4-加成反應,化學方程式為![]() + Br2→
+ Br2→![]() ,④為
,④為![]() 在氫氧化鈉水溶液中發生水解反應,化學方程式為
在氫氧化鈉水溶液中發生水解反應,化學方程式為![]() + 2NaOH
+ 2NaOH![]()
![]() + 2NaBr,故答案為:加成;
+ 2NaBr,故答案為:加成;![]() + Br2→
+ Br2→![]() ;消去;
;消去;![]() + 2NaOH
+ 2NaOH![]()
![]() + 2NaBr +2H2O;加成;
+ 2NaBr +2H2O;加成;![]() + Br2→
+ Br2→![]() ;水解(或取代);
;水解(或取代);![]() + 2NaOH
+ 2NaOH![]()
![]() + 2NaBr。
+ 2NaBr。


 學業測評一課一測系列答案
學業測評一課一測系列答案科目:高中化學 來源: 題型:
【題目】FeSO4 溶液放置在空氣中容易變質,因此為了方便使用 Fe2+,實驗室中常保存硫酸亞鐵銨晶體[俗稱“摩爾鹽”,化學式為(NH4)2Fe(SO4)26H2O],它比綠礬或綠礬溶液更穩定。(穩定是指物質放置 在空氣中不易發生各種化學反應而變質)
I.硫酸亞鐵銨晶體的制備與檢驗
(1)某興趣小組設計實驗制備硫酸亞鐵銨晶體。
本實驗中,配制溶液以及后續使用到的蒸餾水都必須煮沸、冷卻后再使用,這樣處理蒸餾水的目的是_______。向 FeSO4 溶液中加入飽和(NH4)2SO4 溶液,經過操作_______、冷卻結晶、過濾、洗滌和干燥后得到一 種淺藍綠色的晶體。
(2)該小組同學繼續設計實驗證明所制得晶體的成分。
①如圖所示實驗的目的是_______,C 裝置的作用是_______。
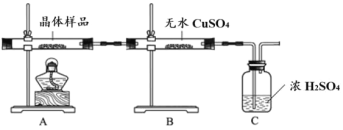
取少量晶體溶于水,得淡綠色待測液。
②取少量待測液,_______ (填操作與現象),證明所制得的晶體中有 Fe2+。
③取少量待測液,經其它實驗證明晶體中有NH4+和SO42-
II.實驗探究影響溶液中 Fe2+穩定性的因素
(3)配制 0.8 mol/L 的 FeSO4 溶液(pH=4.5)和 0.8 mol/L 的(NH4)2Fe(SO4)2 溶液(pH=4.0),各取 2 ml 上述溶液于兩支試管中,剛開始兩種溶液都是淺綠色,分別同時滴加 2 滴 0.01mol/L 的 KSCN 溶液,15 分鐘后觀察可見:(NH4)2Fe(SO4)2溶液仍然為淺綠色透明澄清溶液;FeSO4溶液則出現淡黃色渾濁。
(資料 1)
沉淀 | Fe(OH)2 | Fe(OH)3 |
開始沉淀pH | 7.6 | 2.7 |
完全沉淀pH | 9.6 | 3.7 |
①請用離子方程式解釋 FeSO4 溶液產生淡黃色渾濁的原因_______。
②討論影響 Fe2+穩定性的因素,小組同學提出以下 3 種假設:
假設 1:其它條件相同時,NH4+的存在使(NH4)2Fe(SO4)2 溶液中 Fe2+穩定性較好。
假設 2:其它條件相同時,在一定 pH 范圍內,溶液 pH 越小 Fe2+穩定性越好。
假設 3:_______。
(4)小組同學用如圖裝置(G為靈敏電流計),滴入適量的硫酸溶液分 別控制溶液 A(0.2 mol/L NaCl)和溶液 B(0.1mol/L FeSO4)為不同的 pH,

觀察記錄電流計讀數,對假設 2 進行實驗研究,實驗結果如表所示。
序號 | A:0.2mol·L-1NaCl | B:0.1mol·L-1FeSO4 | 電流計讀數 |
實驗1 | pH=1 | pH=5 | 8.4 |
實驗2 | pH=1 | pH=1 | 6.5 |
實驗3 | pH=6 | pH=5 | 7.8 |
實驗4 | pH=6 | pH=1 | 5.5 |
(資料 2)原電池裝置中,其它條件相同時,負極反應物的還原性越強或正極反應物的氧化性越強,該原 電池的電流越大。
(資料 3)常溫下,0.1mol/L pH=1 的 FeSO4 溶液比 pH=5 的 FeSO4 溶液穩定性更好。 根據以上實驗結果和資料信息,經小組討論可以得出以下結論:
①U 型管中左池的電極反應式____________。
②對比實驗 1 和 2(或 3 和 4) ,在一定 pH 范圍內,可得出的結論為____________。
③對比實驗____________和____________,還可得出在一定pH 范圍內溶液酸堿性變化對 O2 氧化性強弱的影響因素。
④ 對(資料 3)實驗事實的解釋為____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于價電子排布式為![]() 的原子的描述正確的是( )
的原子的描述正確的是( )
A.該原子核外有三種形狀不同的電子云
B.該原子核外電子共有16種不同的運動狀態
C.該原子形成的單質可與H2反應生成常溫下為液態的化合物
D.基態該原子的軌道表示式為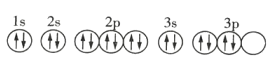
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有A、B、C、D四種短周期主族元素,它們的原子序數依次增大,其中A元素原子核外僅有一個非空原子軌道,也是宇宙中最豐富的元素;B元素原子核外p電子數比s電子數少1;C為金屬元素且原子核外p電子數和s電子數相等;D元素的原子核外所有p軌道為全充滿或半充滿狀態。
(1)寫出四種元素的元素符號:A__________ ,B__________,C__________ ,D__________ 。
(2)寫出C、D兩種元素基態原子的軌道表示式:
C ________________________________
D ___________________________
(3)寫出B、C兩種元素的單質在一定條件下反應的化學方程式:________________________。
(4)B元素的單質的電子式為_____________,其最簡單氫化物的電子式為_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】阿斯巴甜是一種具有清爽甜味的有機化合物,結構簡式如圖所示。下列說法不正確的是( )
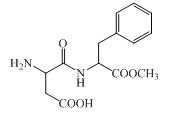
A.分子式為C14H18N2O5
B.不存在順反異構
C.能發生取代和消去反應
D.1 mol阿斯巴甜完全水解最多消耗3 mol NaOH
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知(b)![]() 、(d)
、(d)![]() 、(p)
、(p)![]() 的分子式均為C6H6,下列說法正確的是
的分子式均為C6H6,下列說法正確的是
A. b的同分異構體只有d和p兩種B. b、d、p的二氯代物均只有三種
C. b、d、p均可與酸性高錳酸鉀溶液反應D. b、d、p中只有b的所有原子處于同一平面
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】符合分子式“C6H6”的多種可能結構如圖所示,下列說法正確的是

A. 1~5對應的結構中能使溴的四氯化碳溶液褪色的有4個
B. 1~5對應的結構中一氯取代物只有1種的有3個
C. 1~5對應的結構中所有原子均可能處于同一平面的有1個
D. 1~5對應的結構均能與氫氣在一定條件下發生加成反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)分子式為 C2H6O 的有機物,有兩種同分異構體,乙醇(CH3CH2OH)、甲醚(CH3OCH3),則通過下列方法,不可能將二者區別開來的是 (_________)
A.紅外光譜 B. 1H 核磁共振譜 C.質譜法 D.與鈉反應
(2)有機物 A 只含有 C、H、O 三種元素,常用作有機合成的中間體。16.8g 該有機物在足 量 O2中充分燃燒生成 44.0gCO2 和 14.4gH2O,質譜圖表明其相對分子質量為 84,分析其紅 外光譜圖可知 A 分子中含有 O-H 鍵和位于端點處的 C C 鍵,核磁共振氫譜上有三組峰, 峰面積之比為6:1:1。A的結構簡式是______________________。
(3)已知乙烯分子是平面結構, 1,2-二氯乙烯可形成![]() 和
和![]() 兩種不 同的空間異構體,稱為順反異構。下列能形成類似上述空間異構體的是(_________)
兩種不 同的空間異構體,稱為順反異構。下列能形成類似上述空間異構體的是(_________)
A.1-丙烯 B.4-辛烯 C.1-丁烯 D.2-甲基-1-丙烯
(4)請寫出 C(CH3)3Br與NaOH溶液、乙醇混合加熱的反應方程式__________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下,兩體積均為1 L的容器中發生反應:CO(g)+2H2(g) ![]() CH3OH(g) ΔH。容器中起始各物質的物質的量如下表所示,兩容器中c(H2)隨時間t的變化如下圖所示。
CH3OH(g) ΔH。容器中起始各物質的物質的量如下表所示,兩容器中c(H2)隨時間t的變化如下圖所示。
容器 | 溫度 | CO | H2 | CH3OH |
Ⅰ | T1℃ | a mol | 2 mol | 0 mol |
Ⅱ | T1℃ | 0.5 mol | 1 mol | 0 mol |

下列說法正確的是
A.0~5 min時,容器Ⅰ中v(CO)=0.1 mol·L-1·min-1
B.a>1
C.若容器Ⅱ溫度改變為T2(T2>T1)時,平衡常數K=1,則ΔH<0
D.T1℃時,若向容器Ⅰ中充入CO、H2、CH3OH各1 mol,反應將向逆反應方向進行
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com