
【題目】合金具有許多優良的物理、化學或機械性能.下列物質屬于合金的是( )
A.水銀
B.不銹鋼
C.陶瓷
D.玻璃
 百年學典課時學練測系列答案
百年學典課時學練測系列答案科目:高中化學 來源: 題型:
【題目】在1.0 L恒容密閉容器中放入0.10 mol X,在一定溫度下發生反應:X(g)![]() Y(g)+Z(g) ΔH<0,容器內氣體總壓強p隨反應時間t的變化關系如圖所示。以下分析正確的是( )
Y(g)+Z(g) ΔH<0,容器內氣體總壓強p隨反應時間t的變化關系如圖所示。以下分析正確的是( )
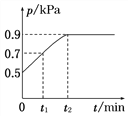
A. 該溫度下此反應的平衡常數K=3.2
B. 從反應開始到t1時的平均反應速率v(X)=![]() mol·L-1·min-1
mol·L-1·min-1
C. 欲提高平衡體系中Y的百分含量,可加入一定量的X
D. 其他條件不變,再充入0.1 mol氣體X,平衡正向移動,X的轉化率減少
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于反應2KI+O3+H2O ==2KOH+I2+O2,下列說法正確的是
A.當有2 molKI被氧化時,2 mol氧原子被還原
B.O2是還原產物
C.若消耗2.24 L O3,則轉移0.2 mol電子
D.氧化劑與還原產物的物質的量之比為1:1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氰化鈉是一種重要的基本化工原料,同時也是一種劇毒物質,嚴重危害人類健康。一旦泄露需要及時處理,一般可以通過噴灑雙氧水或硫代硫酸鈉溶液來處理,以減輕環境污染。 I.已知:氧化鈉化學式為NaCN,氰化鈉是一種白色結晶顆粒,劇毒,易溶于水,水溶液呈堿性,易水解生成氰化氫。
(1)請設計實驗證明N、C 元素的非金屬性強弱:____________________。
(2)NaCN用雙氧水處理后,產生一種酸式鹽和一種能使濕潤紅色石蕊試紙變藍的氣體,該反應的離子方程式是_______________________________。
II.工業制備硫代硫酸鈉的反應原理為2Na2S+Na2CO3+4SO2==3Na2S2O3+CO2。某化學興趣小組用上述原理實驗室制備硫代硫酸鈉,并檢測用硫代硫酸鈉溶液處理后的氰化鈉廢水能否達標排放。
【實驗一】實驗室通過如下圖所示裝置制備Na2S2O3。
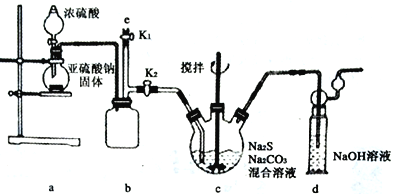
(1)實驗中要控制SO2 生成速率,可采取的措施有_______________________(寫出一條)。
(2)b裝置的作用是____________________________________。
(3)反應開始后,c中先有淡黃色渾濁產生,后又變為澄清,此渾濁物為___________(填化學式)。
(4)實驗結束后,在e處最好連接盛_________(填“NaOH 溶液”、“水”、“CCl4” 中一種)的注射器,接下來的操作為關閉K2 打開K1,最后拆除裝置。
【實驗二】測定用硫代硫酸鈉溶液處理后的廢水中氰化鈉的含量。
已知:①廢水中氰化鈉的最高排放標準為0.50mg/L;
②Ag++2CN-=[Ag(CN)2]-,Ag++I-=AgI↓,AgI呈黃色,且CN-優先與Ag+反應。
實驗如下:取200.00mL處理后的氰化鈉廢水于錐形瓶中,并滴加幾滴KI溶液作指示劑,
用1.00×10-4mol/L 的標準AgNO3溶液滴定,消耗AgNO3溶液的體積為1.50mL。
(5)滴定終點的現象:________________________________________。
(6)處理后的廢水是否達到排放標準:_______________________________(填“是”或“否”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】
某芳香烴A(相對分子質量為92)是一種重要的有機化工原料,以它為初始原料經過如下轉化關系圖(部分產物、合成路線、反應條件略去)可以合成阿司匹林、扁桃酸等物質。其中D能與銀氨溶液發生銀鏡反應。
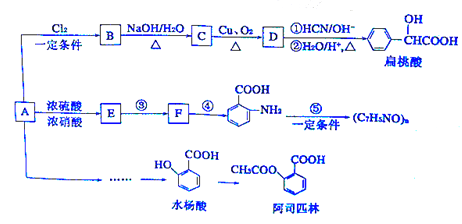
已知:
I. ![]() (苯膠,易被氧化)
(苯膠,易被氧化)
II. ![]() (X為Cl或Br)
(X為Cl或Br)
III.大多數含一個支鏈苯的同系物易被酸性KMnO4氧化為苯甲酸
(1)D 的結構簡式為:____________________,B轉化為C 的反應類型為:________________。
(2)符合下列條件的扁桃酸的同分異構體共有___________種。
①屬于甲酸酯 ②含有酚羥基
(3)反應③和④順序能否對換?_______(填“能”或“不能”);理由是:___________________。
(4)寫出反應⑤的化學方程式:________________________________。
(5)試寫出由A 合成水楊酸的合理流程圖:
①合成過程中無機試劑任選
②合成反應流程圖表示方法示例如下:
![]()
_________________________________________________________________________________________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】銅元素位于元素周期表中第ⅠB族,在化合物中其化合價可以呈現+1、+2價。銅的單質及其化合物在很多領域有重要的應用。
Ⅰ.CuSO4和Cu(NO3)2是常見的+2價銅的化合物,有較為廣泛的應用。
(1)向CuSO4溶液中滴加氨水,最后可以得到深藍色的[Cu(NH3)4]SO4溶液。
N、O、S三種元素的第一電離能由大到小的順序為______________________________。
(2)制備Cu(NO3)2的一種方法是在N2O4的乙酸乙酯溶液中加入銅,反應一段時間后,加熱即可得到Cu(NO3)2。NO3-的立體構型的名稱為_______________,N原子的雜化方式為________________。NO3-的一種等電子體為________________________。
Ⅱ.CuCl是較為常見的十1價銅的化合物。
(3)基態Cu+的價層電子排布式為________________________。
(4)CuCl的晶胞結構如圖所示,C1原子位于立方體的頂點和面心, Cu原子位于Cl原子構成的四面體體心。每個Cl原子周圍距Cl原子最近且等距離的Cu原子數目為________________。
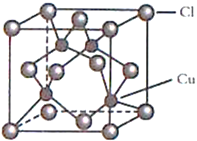 。
。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】指甲花中存在的β-紫羅藍酮屬于一種萜類化合物,可作為合成維生素A的原料。下列有關β-紫羅藍酮的說法正確的是
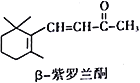
A. β-紫羅藍酮的分子式為C10H14O
B. 分子中所有碳原子可能處于同一平面
C. 與足量的H2反應后,分子中官能團的種類減少一種
D. 和酸性KMnO4溶液、溴的四氯化碳溶液發生的反應類型相同
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com