

分析 (1)根據蓋斯定律將(Ⅰ)×2+(Ⅱ)×2+(Ⅲ)計算書寫熱化學方程式;
(2)根據平衡體系中各組分的體積分數均為$\frac{1}{4}$,利用三段式計算出平衡時各組分的含量,計算平衡常數和轉化率;
(3)①依據轉化率曲線分析判斷;②圖象分析速率隨溫度變化的趨勢分析回答;
(4)①原電池中失電子的為負極;正極上ClO-得電子生成氯離子;②Mg的活潑性較強能與水反應生成氫氣;
(5)①N電極上HOOC-COOH得電子生成HOOC-CHO;②2mol H+通過質子交換膜,則電池中轉移2mol電子,根據電極方程式計算;
(6)本題的關健是對圖象的解讀.剛開始時陰極Cu2+得電子,無氣體放出,Cu2+反應完溶液中的H+放電,Ⅰ是H2,陽極先是溶液中的Cl-放電,反應完后溶液中的OH-放電,電解200mL一定濃度的NaCl與CuSO4混合溶液,陽極發生2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O,陰極發生Cu2++2e-=Cu、2H++2e-=H2↑,結合圖可知,Ⅰ為陰極氣體體積與時間的關系,Ⅱ為陽極氣體體積與時間的關系,計算時抓住電子守恒.
解答 解:(1)根據(Ⅰ)CH4(g)+CO2(g)?2CO(g)+2H2(g)△H1=+247.3kJ•mol-1
(Ⅱ)CO(g)+2H2(g)?CH3OH(g)△H2=-90.1kJ•mol-1
(Ⅲ)2CO(g)+O2(g)?2CO2(g)△H3=-566.0kJ•mol-1
由(Ⅰ)×2+(Ⅱ)×2+(Ⅲ)得2CH4(g)+O2(g)?2CH3OH(g)△H,故△H=2△H1+2△H2+△H3=(+247.3kJ•mol-1)×2+(-90.1kJ•mol-1)×2+(-566.0kJ•mol-1)=-251.6kJ•mol-1,所以用CH4和O2直接制備甲醇蒸氣的熱化學方程式為2CH4(g)+O2(g)?2CH3OH(g)△H=-251.6kJ•mol-1,故答案為:2CH4(g)+O2(g)?2CH3OH(g)△H=-251.6kJ•mol-1;
(2)CH4(g)+CO2(g)?2CO(g)+2H2(g)
起始(mol) 6 6 0 0
變化(mol) x x 2x 2x
平衡(mol)6-x 6-x 2x 2x
平衡體系中各組分的體積分數均為$\frac{1}{4}$,所以6-x=2x,解得x=2,
則此溫度下該反應的平衡常數K=$\frac{{c}^{2}(CO)×{c}^{2}({H}_{2})}{c(C{H}_{4})×c(C{O}_{2})}=\frac{{1}^{2}×{1}^{2}}{1×1}$=1,
CH4的轉化率為$\frac{2}{6}$=33.3%,故答案為:1;33.3%;
(3)①從反應壓強對甲醇轉化率的影響“效率“看,圖象中轉化率變化最大的是4.0×106Pa,故答案為:4.0×106Pa;
②依據圖象分析溫度在高于80°C對反應速率影響不大,反應是放熱反應,溫度過高,平衡逆向進行,不利于轉化率增大,
故答案為:高于80℃時,溫度對反應速率影響較小,且反應放熱,升高溫度時平衡逆向移動,轉化率降低;
(4)①“鎂-次氯酸鹽”燃料電池中失電子的為負極,則Mg為負極;正極上ClO-得電子生成氯離子,則正極的電極反應式為:ClO-+2e-+H2O═Cl-+2OH-;故答案為:負;ClO-+2e-+H2O═Cl-+2OH-;
②Mg的活潑性較強能與水反應生成氫氣,其反應為:Mg+2H2O═Mg(OH)2+H2↑,故答案為:Mg+2H2O═Mg(OH)2+H2↑;
(5)①N電極上HOOC-COOH得電子生成HOOC-CHO,則電極反應式為HOOC-COOH+2e-+2H+═HOOC-CHO+H2O,故答案為:HOOC-COOH+2e-+2H+═HOOC-CHO+H2O;
②2mol H+通過質子交換膜,則電池中轉移2mol電子,根據電極方程式HOOC-COOH+2e-+2H+═HOOC-CHO+H2O,可知生成1mol乙醛酸,由于兩極均有乙醛酸生成所以生成的乙醛酸為2mol;故答案為:2;
(6)①電解200mL一定濃度的NaCl與CuSO4混合溶液,陽極發生2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O,陰極發生Cu2++2e-=Cu、2H++2e-=H2↑,所以陽極上先產生氣體,曲線Ⅱ表示陽極產生氣體的變化,故答案為:Ⅱ;
②結合圖可知,Ⅰ為陰極氣體體積與時間的關系,Ⅱ為陽極氣體體積與時間的關系①由圖可知,產生氯氣為224mL,則由2Cl--2e-=Cl2↑可知,n(NaCl)=$\frac{0.224L}{22.4L/mol}$×2=0.02mol,所以c(NaCl)=$\frac{0.02mol}{0.2L}$=0.1mol/L,
由t2時生成氧氣為112mL,n(O2)=$\frac{0.112L}{22.4L/mol}$=0.005mol,則共轉移電子為0.02mol+0.005mol×4=0.04mol,
根據電子守恒及Cu2++2e-=Cu可知,n(CuSO4)=$\frac{0.04mol}{2}$=0.02mol,所以c(CuSO4)=$\frac{0.02mol}{0.2L}$=0.1mol/L,
故答案為:0.1mol/L;0.1mol/L;
③由t2時4OH--4e-=O2↑+2H2O~4H+,n(H+)=0.005mol×4=0.02mol,則溶液的c(H+)=$\frac{0.02mol}{0.2L}$=0.1mol/L,pH=1,故答案為:1.
點評 本題考查了蓋斯定律的應用、熱化學方程式的計算書寫、化學平衡的計算、圖象分析判斷以及電化學的知識等,注意掌握基礎知識的掌握,題目難度中等.


科目:高中化學 來源: 題型:選擇題
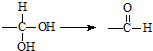 .有機物
.有機物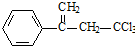 是選擇性內吸傳導性除草劑,俗稱稗草烯,主要用于水稻田防除稗草,溫度和濕度對藥效影響大,溫度高、濕度大藥效發揮快.下列有關該有機物的說法不正確的是( )
是選擇性內吸傳導性除草劑,俗稱稗草烯,主要用于水稻田防除稗草,溫度和濕度對藥效影響大,溫度高、濕度大藥效發揮快.下列有關該有機物的說法不正確的是( )| A. | 屬于鹵代烴,能使酸性高錳酸鉀溶液和溴水褪色 | |
| B. | 該物質既有對映異構,也有順反異構 | |
| C. | 在堿性條件下充分水解,可生成羧酸鹽 | |
| D. | 1mol 該物質在一定條件下可與4molH2發生加成反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
. 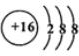 ;D與E能形成一種所有原子最外層均滿足8電子的分子,該分子的結構式為S=C=S;D所在族元素的氫化物中,沸點最低的是H2S.
;D與E能形成一種所有原子最外層均滿足8電子的分子,該分子的結構式為S=C=S;D所在族元素的氫化物中,沸點最低的是H2S.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |

| 化學式 | 電離平衡常數 |
| HCN | K=4.9×10-10 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | K+.Al3+.Cl-.NO3- | B. | K+.Fe3+.Cl-.SiO32- | ||
| C. | H+.Fe2+.SO42-.Br2 | D. | K+.Ag+.NH3•H2O.NO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①是非氧化還原反應,而②是氧化還原反應 | |
| B. | 上述反應中SO2的作用只相當于催化劑 | |
| C. | 反應②中CuSO4是氧化產物 | |
| D. | 反應①中SO2發生還原反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 有A、B、C、D、E五種原子序數依次增大的元素(原子序數均小于30).A的基態原子2p能級有3個單電子;C的基態原子2p能級有1個單電子;E原子最外層有1個單電子,其次外層有3個能級且均排滿電子;D與E同周期,價電子數為2.則:
有A、B、C、D、E五種原子序數依次增大的元素(原子序數均小于30).A的基態原子2p能級有3個單電子;C的基態原子2p能級有1個單電子;E原子最外層有1個單電子,其次外層有3個能級且均排滿電子;D與E同周期,價電子數為2.則:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
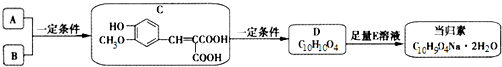
 .
. .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
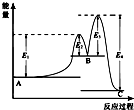 某反應由兩步反應A═B═C構成,它的反應能量曲線如圖所示(E1、E2、E3、E4表示活化能).下列有關敘述正確的是( )
某反應由兩步反應A═B═C構成,它的反應能量曲線如圖所示(E1、E2、E3、E4表示活化能).下列有關敘述正確的是( )| A. | A═B的反應熱△H=+(E2-E1)KJ/mol | B. | 三種化合物中C最穩定 | ||
| C. | C═B 是放熱反應 | D. | 整個反應中△H=E1-E4 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com