
 ;D在元素周期表中的位置為第三周期ⅢA族.
;D在元素周期表中的位置為第三周期ⅢA族.分析 A、B、C、D、E是短周期中原子序數依次增大的主族元素,元素D的合金是日常生活中常用的金屬材料,則D為Al;常溫常壓下,E單質是淡黃色固體,常在火山口附近沉積,則E為S.元素C在同周期的主族元素中原子半徑最大,則C處于IA族,元素B的原子最外層電子數是其電子層數的2倍,B原子只能有2個電子層,最外層電子數為4,故B為碳元素,可推知C為Na;元素A的單質在常溫下呈氣態,則A為H元素.
(1)CA為NaH,和水反應生成氫氧化鈉和氫氣;
(2)CA為NaH,由鈉離子與氫負離子構成;鋁元素在周期表中位于第三周期ⅢA族;
(3)硫化氫的燃燒熱表示為1摩爾硫化氫完全燃燒生成液態水和二氧化硫氣體時放出aKJ的熱量;
(4)甲、乙、丙分別是B、D、E三種元素最高價含氧酸的鈉鹽,甲、乙都能與丙發生反應,且丙用量不同,反應的產物不同,甲為碳酸鈉,乙為偏鋁酸鈉,丙為硫酸氫鈉.
①硫酸氫鈉中滴加過量的偏鋁酸鈉,先生成硫酸鋁,后硫酸鋁和偏鋁酸鈉反應生成氫氧化鋁;
②碳酸鈉中加入等物質的量的硫酸氫鈉,反應生成等物質的量的碳酸氫鈉和硫酸鈉,碳酸氫根離子水解程度大于其電離程度,溶液呈堿性;
(5)鋁做陽極失去電子,生成鋁離子,和碳酸氫根雙水解生成氫氧化鋁和二氧化碳;氫氧化鋁受熱分解生成氧化鋁和水.
解答 解:A、B、C、D、E是短周期中原子序數依次增大的主族元素,元素D的合金是日常生活中常用的金屬材料,則D為Al;常溫常壓下,E單質是淡黃色固體,常在火山口附近沉積,則E為S.元素C在同周期的主族元素中原子半徑最大,則C處于IA族,元素B的原子最外層電子數是其電子層數的2倍,結合原子序數可知,B原子只能有2個電子層,最外層電子數為4,故B為碳元素,可推知C為Na;元素A的單質在常溫下呈氣態,則A為H元素.
(1)CA為NaH,和水反應生成氫氧化鈉和氫氣,反應方程式為:NaH+H2O=NaOH+H2↑,
故答案為:NaH+H2O=NaOH+H2↑;
(2)B為碳元素,符號為C,CA為NaH,電子式為: ,鋁元素在周期表中的位置為:第三周期ⅢA族,
,鋁元素在周期表中的位置為:第三周期ⅢA族,
故答案為:C; ;第三周期ⅢA族;
;第三周期ⅢA族;
(3)硫化氫的燃燒熱表示為1摩爾硫化氫完全燃燒生成液態水和二氧化硫氣體時放出aKJ的熱量,熱化學方程式為:H2S(g)+$\frac{3}{2}$O2(g)=H2O(l)+SO2(g)△H=-aKJ/mol,
故答案為:H2S(g)+$\frac{3}{2}$O2(g)=H2O(l)+SO2(g)△H=-aKJ/mol;
(4)甲、乙、丙分別是B、D、E三種元素最高價含氧酸的鈉鹽,甲、乙都能與丙發生反應,且丙用量不同,反應的產物不同,甲為碳酸鈉,乙為偏鋁酸鈉,丙為硫酸氫鈉.
①硫酸氫鈉中滴加過量的偏鋁酸鈉,先生成硫酸鋁,后硫酸鋁和偏鋁酸鈉反應生成氫氧化鋁,離子方程式為:4H++AlO2-=Al3++2H2O;Al3++3AlO2-+6H2O=4Al(OH)3↓,
故答案為:4H++AlO2-=Al3++2H2O;Al3++3AlO2-+6H2O=4Al(OH)3↓;
②碳酸鈉中加入等物質的量的硫酸氫鈉,反應生成等物質的量的碳酸氫鈉和硫酸鈉,碳酸氫根離子水解程度大于其電離程度,溶液呈堿性,溶液中離子濃度順序為:c(Na+)>c(SO42-)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)>c(CO32-),
故答案為:c(Na+)>c(SO42-)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)>c(CO32-);
(5)鋁做陽極失去電子,生成鋁離子,和碳酸氫根雙水解生成氫氧化鋁和二氧化碳,陽極電極反應為:Al+3HCO3--3e-=Al(OH)3+3CO2↑;氫氧化鋁受熱分解生成氧化鋁和水,反應方程式為:2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O,
故答案為:Al+3HCO3--3e-=Al(OH)3+3CO2↑;2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O.
點評 本題考查結構性質位置關系應用,題目比較綜合,涉及電子式、熱化學方程式、元素化合物性質、離子濃度大小比較、電解原理等,是對學生綜合能力的考查,難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 未成熟蘋果的果肉遇碘水會變藍 | |
| B. | 與鋅塊相連或與電源正極相連,鋼鐵一定能被保護 | |
| C. | 纖維素和油脂均可發生水解,都屬于天然高分子化合物 | |
| D. | 加酶洗衣粉可以很好的洗滌毛織品上的污漬 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
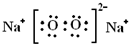 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NA個Cl2在常溫常壓下體積約為22.4L | |
| B. | 在20℃、101kPa時,22.4L氫氣中約含有2NA個氫原子 | |
| C. | 25℃、1.01×105Pa,48g SO2中含有的原子數為3NA | |
| D. | 22 g二氧化碳與標準狀況下11.2LHCl含有相同的分子數 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1molNa2O2中含有的離子數為0.4NA | |
| B. | 利用氧化還原反應原理制取1mol氧氣,轉移的電子數一定為4NA | |
| C. | 7.1g氯氣與足量NaOH溶液反應電子轉移數為0.2NA | |
| D. | 0.1mol氯氣與金屬鐵完全反應時,轉移電子數為0.2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 只有Na2O | B. | 只有Na2O2 | C. | Na2O和Na2O2 | D. | 無法確定 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

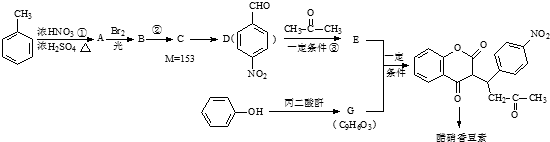

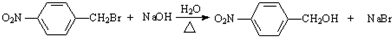 ;
;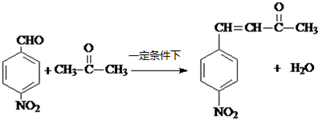 ;
;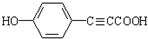 ;
;查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | E | R | F | |||||
| 3 | A | C | D | H | I | G | ||
| 4 | B |
 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com