
(13分)實驗室配制500mL 0.5mol/L的NaCl溶液,有如下操作步驟:①把稱量好的NaCl晶體放入小燒杯中,加適量蒸餾水溶解;②把①所得溶液小心轉入500mL容量瓶中;③繼續向容器瓶中加蒸餾水至液面距刻度2cm~3cm處,改用膠頭滴管小心滴加蒸餾水至溶液凹液面底部與刻度線相切;④用少量蒸餾水洗滌燒杯和玻璃棒2~3次,每次洗滌液都小心轉入容量瓶,并輕輕搖勻;⑤將容量瓶塞緊,充分搖勻.
(1)操作步驟的正確順序為(填序號):_____________________________________
(2)本實驗用到的基本儀器有:___________________________________________
_____________________________________________________________________
(3)若出現如下情況,所配溶液濃度將偏高、偏低,還是不變。
沒有進行操作步驟④,會______;加蒸餾水時不慎超過了,會______;定容時俯視會______;若洗滌容量瓶后,有少量的水分殘留在容量瓶中,會______。
(4)若實驗過程中出現如下情況應如何處理?加蒸餾水時不慎超過了刻度,應
____________________________________________________________________;
向容量瓶中轉移溶液時(實驗步驟②)不慎有液滴掉在容量瓶外面,應
__________________________________________________________________。
(1)(2分)①②③④⑤
(2)(5分)托盤天平、燒杯、玻璃棒、500 mL容量瓶、膠頭滴管
(3)(4分)偏低 偏低 偏高 不變
(4)(2分)倒掉重配 倒掉重配
解析試題分析:(1)溶液的配制過程:計算—稱量(量取)—溶解(稀釋)—移液—洗滌—定容—搖勻—裝瓶。因此其正確的步驟為①②③④⑤。
(2)所需的基本儀器可由實驗步驟聯想得出:托盤天平、燒杯、玻璃棒、500 mL容量瓶、膠頭滴管。
(3)對于誤差的分析,應把握住基本的計算公式: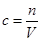 。“沒有洗滌燒杯、玻璃棒”,會使得溶質的量減少,從而導致濃度偏低。“加蒸餾水時不慎超過”,會使得體積變大,從而導致溶液濃度偏低。“定容時俯視”實際體積偏小,濃度變大。“少量水殘留在容量瓶中”對濃度無影響。
。“沒有洗滌燒杯、玻璃棒”,會使得溶質的量減少,從而導致濃度偏低。“加蒸餾水時不慎超過”,會使得體積變大,從而導致溶液濃度偏低。“定容時俯視”實際體積偏小,濃度變大。“少量水殘留在容量瓶中”對濃度無影響。
(4)在配制溶液的過程中,出錯了應重新配制,否則會使配得的溶液濃度出現錯誤。
考點:一定物質的量溶液的配制
點評:本題以實驗題的形式考查了“一定物質的量溶液的配制”問題。屬于課本的基礎知識。熟練掌握課本的知識,不難得出正確答案。另一方面,無論對什么題的誤差分析,都應從其計算公式入手,判斷操作過程中對量的大小的影響,從而判斷誤差偏大、偏小或者不變。


 口算題天天練系列答案
口算題天天練系列答案科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
查看答案和解析>>
科目:高中化學 來源: 題型:
 實驗室配制500mL 0.2mol?L-1的Na2SO4溶液,實驗操作步驟有:
實驗室配制500mL 0.2mol?L-1的Na2SO4溶液,實驗操作步驟有:查看答案和解析>>
科目:高中化學 來源: 題型:
 實驗室配制500mL 0.4mol/L的NaCl溶液,有如下操作步驟:
實驗室配制500mL 0.4mol/L的NaCl溶液,有如下操作步驟:查看答案和解析>>
科目:高中化學 來源: 題型:
 實驗室配制500mL 0.500mol?L-1的NaCl溶液,有如下操作步驟:
實驗室配制500mL 0.500mol?L-1的NaCl溶液,有如下操作步驟:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com