

分析 (1)已知①N2(g)+2O2(g)═N2O4(l),△H=-19.5kJ/mol;
②N2H4(l)+O2(g)═N2(g)+2H2O(l),△H=-622.0kJ/mol;
③H2O(g)=H2O(l)△H=-44.0kJ/mol;
利用蓋斯定律將②×2-①-③×4可得2N2H4(l)+N2O4(g)═3N2(g)+4H2O(g),并以此計算反應熱;
(2)①c(NO2)越大,顏色越深;根據圖中的數據計算出平衡時各物質的濃度,再計算平衡常數;
②D點要達平衡,必須降低N2O4的百分含量,也就是逆向建立平衡,E點要到達平衡,必須升高N2O4的百分含量,正向建立平衡,A、B、C三點都在平衡線上,所以此三點的正逆反應速率相等;
溫度越高反應速率越大,反應達到平衡時間越短;
(3)根據圖3t1時刻改變條件后v(正)瞬間增大,v(逆)減小,v(正)<v(逆),則平衡一定正向移動,據此分析;
(4)該反應是一個反應前后氣體體積增大的且是正反應是吸熱的化學反應,t2時逆反應速率增大,且平衡時反應速率大于t2時反應速率,平衡向逆反應方向移動,t8時反應速率增大,但平衡不移動,根據外界條件對化學反應速率的影響來分析解答.
解答 解:(1)已知①N2(g)+2O2(g)═N2O4(l),△H=-19.5kJ/mol;
②N2H4(l)+O2(g)═N2(g)+2H2O(l),△H=-622.0kJ/mol;
③H2O(g)=H2O(l)△H=-44.0kJ/mol;
利用蓋斯定律將②×2-①-③×4可得2N2H4(l)+N2O4(g)═3N2(g)+4H2O(g)△H=-1048.5kJ/mol,
故答案為:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g)△H=-1048.5kJ/mol;
(2)①從a到b,c(NO2)增大,c點和d點分別是增大c(NO2)后未達到平衡的點和平衡時的點,所以c點c(NO2)大于d點,二氧化氮濃度越大顏色越深,故顏色由深到淺的順序是?c>d>b>a,由題圖可知,平衡時c(NO2)=0.6mol•L-1,c(N2O4)=0.4mol•L-1,故該溫度下該反應的平衡常數K=$\frac{0.4}{0.{6}^{2}}$=1.11,
故答案為:?c>d>b>a;1.11;
②A、B、C三點都在平衡線上,所以此三點的正逆反應速率相等,D點要達平衡,必須降低N2O4的百分含量,也就是逆向建立平衡,從而得出v(正)<v(逆),E點要達平衡,必須提高N2O4的百分含量,也就是正向建立平衡,從而得出v(正)>v(逆);
溫度越高反應速率越大,反應達到平衡時間越短,因為t1<t2,所以x>y,
故答案為:D;>;
(3)根據圖3t1時刻改變條件后v(正)瞬間增大,v(逆)減小,v(正)<v(逆),則平衡一定正向移動,故A正確;
故答案為:A;
(4)t1到t6平衡都逆向移動,而t6時平衡正向移動,是因為增加反應物的濃度,而C是固體,所以是增加水蒸氣的量,所以本身的轉化率降低,t8時反應速率增大,但平衡不移動,故平衡轉化率最低t7-t8 (或“t7到t8”),t4時刻速率都比原來速率小,平衡逆向,所以是降低溫度,
故答案為:t7-t8;降低溫度.
點評 本題綜合考查了蓋斯定律的應用、化學平衡和化學反應速率等知識,題目難度中等,題目涉及蓋斯定律在計算中的應用、影響反應速率的因素、化學平衡的影響因素和平衡常數的計算等,做題時注意把握影響平衡移動的因素以及平衡常數的有關計算,此為化學平衡常考查問題.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | H2SO4與K2CO3;HNO3與Na2CO3 | B. | CH3COOH與KOH;HCl與NaOH | ||
| C. | BaCl2與Na2SO4;Ba(OH)2與(NH4)2SO4 | D. | HCl與Na2CO3;HCl與NaHCO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
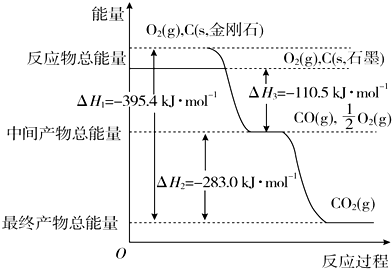
| 化學式 | H2(g) | CO(g) | CH3OH(l) |
| 標準燃燒熱(25℃) △H/kJ•mol-1 | -285.8 | -283.0 | -726.5 |

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
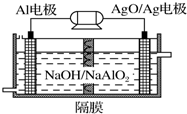 鋁是地殼中含量最高的金屬元素,其單質及合金在生產生活中的應用日趨廣泛.
鋁是地殼中含量最高的金屬元素,其單質及合金在生產生活中的應用日趨廣泛.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在常溫下,放熱反應一般能自發進行,吸熱反應都不能自發進行 | |
| B. | NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g)△H=+185.57kJ/mol,能自發進行,原因是體系有自發地向混亂度增加的方向轉變的傾向 | |
| C. | 氯化鈷溶液中存在平衡: [Co(H2O)6]2+(粉紅色)+4Cl-?[CoCl4]2-(藍色)+6H2O;△H=akJ•mol-1,將氯化鈷溶液置于冰水浴中,溶液變成粉紅色,則可知:a<0 | |
| D. | 用容量瓶配制一定物質的量濃度的溶液,定容時俯視刻度線,所配溶液濃度偏小 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 實驗室配制的亞鐵鹽溶液在空氣中被氧化:4Fe2++O2+2H2O═4Fe3++4OH- | |
| B. | 以金屬銀為陽極電解飽和硫酸銅溶液:Cu2++2H2O$\frac{\underline{\;通電\;}}{\;}$2Cu+O2↑+4H+ | |
| C. | Ca(ClO)2溶液中通入過量的SO2氣體:ClO-+SO2+H2O═HClO+HSO3- | |
| D. | 用酸化的高錳酸鉀溶液氧化雙氧水:2 MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com