
【題目】下列各項內容,排列順序正確是( )
①固體的熱穩定性:Na2CO3>CaCO3>NaHCO3
②常見離子的還原性排序:S2->I->Fe2+
③微粒半徑:K+>S2->F-
④給出質子的能力:CH3COOH>C2H3OH>H2O
⑤氫化物的沸點:H2Se>H2S>H2O
A.①③B.②④C.①②D.③⑤
 通城學典默寫能手系列答案
通城學典默寫能手系列答案科目:高中化學 來源: 題型:
【題目】常溫下,下列有關敘述正確的是
A. 向0.1 mol·L1 Na2CO3溶液中通入適量CO2氣體后:c(Na+)=2[c(![]() )+c(
)+c(![]() )+c(H2CO3)]
)+c(H2CO3)]
B. 常溫下,pH=6的NaHSO3溶液中:c(![]() )c(H2SO3)=9.9×107 mol·L1
)c(H2SO3)=9.9×107 mol·L1
C. 等物質的量濃度、等體積的Na2CO3和NaHCO3混合:![]() <
<![]()
D. 0.1 mol·L1 Na2C2O4溶液與0.1 mol·L1 HCl溶液等體積混合(H2C2O4為二元弱酸):2c(![]() )+c(
)+c(![]() )+c(OH)=c(Na+)+c(H+)
)+c(OH)=c(Na+)+c(H+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】燃煤產生的煙氣中的氮氧化物NOx(主要為NO、NO2)易形成污染,必須經脫除達標后才能排放。
(1)用化學方程式表示NO形成硝酸型酸雨的反應______
(2)能作脫除劑的物質很多,下列說法正確的是______
a.用H2O作脫除劑,不利于吸收含氮煙氣中的NO
b.用Na2SO3作脫除劑,O2會降低Na2SO3的利用率
c.用CO作脫除劑,會使煙氣中NO2的濃度增加
(3)尿素[CO(NH2)2]在一定條件下能有效將NOx轉化為N2
Ⅰ.已知可通過下列方法合成尿素:2NH3(g)+CO2(g)![]() H2NCOONH4(s)△H=-159.5kJ/mol
H2NCOONH4(s)△H=-159.5kJ/mol
H2NCOONH4(s)![]() CO(NH2)2(s)+H2O(l) △H=+28.5kJ/mol
CO(NH2)2(s)+H2O(l) △H=+28.5kJ/mol
①尿素釋放出NH3的熱化學方程式是______。
②寫出有利于尿素釋放NH3的條件并說明理由______。
ⅡCO(NH2)2與某種煙氣![]() 主要為N2、NO和O2)中的NO的物質的量比值分別為1:2、2:1、3:1時,NO脫除率隨溫度變化的曲線如圖:
主要為N2、NO和O2)中的NO的物質的量比值分別為1:2、2:1、3:1時,NO脫除率隨溫度變化的曲線如圖:
①曲線a對應CO(NH2)2與NO的物質的量比值是______。
②曲線a、b、c中,800℃~900℃區間內發生主要反應的化學方程式是______。
③900℃~1200℃區間內脫除率下降,NO濃度上升,發生的主要反應是______。
④曲線a中,NO的起始濃度為6×10-4mg/m3,從A點到B點經過0.8s,該時間段內NO的脫除速率為______mg/(m3·s) 。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知下表為![]() 時某些弱酸的電離平衡常數。依據所給信息判斷,下列說法正確的是( )
時某些弱酸的電離平衡常數。依據所給信息判斷,下列說法正確的是( )
| HClO |
|
|
|
|
A.向NaClO溶液中通入少量二氧化碳的離子方程式為:![]()
B.相同濃度的![]() 和NaClO的混合溶液中,
和NaClO的混合溶液中,![]()
C.向![]() 溶液中加入少量水,溶液中pH增大
溶液中加入少量水,溶液中pH增大
D.25℃時,![]() 溶液通入
溶液通入![]() 至溶液的
至溶液的![]() 時,溶液中:
時,溶液中:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)氯酸鉀熔化,粒子間克服了________的作用力;二氧化硅熔化,粒子間克服了________的作用力;碘的升華,粒子間克服了________的作用力。
(2)在H2、(NH4)2SO4、SiC、CO2、HF中,由極性鍵形成的非極性分子有________,由非極性鍵形成的非極性分子有________,能形成分子晶體的物質是________,含有氫鍵的晶體的化學式是________,屬于離子晶體的是________,屬于原子晶體的是________,五種物質的熔點由高到低的順序是____________________________。
(3)A、B、C、D為四種晶體,性質如下:
A.固態時能導電,能溶于鹽酸
B.能溶于CS2,不溶于水
C.固態時不導電,液態時能導電,可溶于水
D.固態、液態時均不導電,熔點為3500℃
試推斷它們的晶體類型:
A________;B________;C________;D________。
(4)如圖中A~D是中學化學教科書上常見的幾種晶體結構模型,請填寫相應物質的名稱:A________;B________;C________;D________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】![]() 為二元弱酸,
為二元弱酸,![]() ,
,![]() ,設
,設![]() 溶液中
溶液中![]() 。室溫下用NaOH溶液滴定
。室溫下用NaOH溶液滴定![]() 溶液至終點。滴定過程得到的下列溶液中微粒的物質的量濃度關系一定正確的是( )
溶液至終點。滴定過程得到的下列溶液中微粒的物質的量濃度關系一定正確的是( )
A.![]() 溶液:
溶液:![]()
B.![]() 的溶液:
的溶液:![]()
C.![]() 的溶液:
的溶液:![]()
D.![]() 的溶液:
的溶液:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據化學原理的相關知識填空。
⑴常溫時,![]() 的水溶液呈酸性,原因是
的水溶液呈酸性,原因是![]() 用離子方程式表示
用離子方程式表示![]() :___________,將
:___________,將![]() 溶液蒸干,灼燒,最后得到的固體產物主要是__________
溶液蒸干,灼燒,最后得到的固體產物主要是__________![]() 填化學式
填化學式![]() 。
。
⑵向![]() 溶液滴加石蕊溶液后變紅,則
溶液滴加石蕊溶液后變紅,則![]() 的電離程度______其水解程度
的電離程度______其水解程度![]() 填“
填“![]() ”或“
”或“![]() ”或“
”或“![]() ”
”![]() 。該物質能_______
。該物質能_______![]() 填“促進”或“抑制”
填“促進”或“抑制”![]() 水的電離。
水的電離。
⑶若想除去![]() 溶液中混有
溶液中混有![]() 雜質,則往往加入試劑 ________。
雜質,則往往加入試劑 ________。
![]()
![]()
![]()
![]()
⑷泡沫滅火器的滅火原理為___________![]() 用離子方程式解釋
用離子方程式解釋![]()
⑸在蘇打溶液中存在的電荷守恒式為__________;質子守恒式為__________
⑹常溫下,物質的量濃度相同的下列溶液:![]()
![]()
![]()
![]()
![]() 溶液中
溶液中![]() 從大到小排列順序為________
從大到小排列順序為________![]() 填序號
填序號![]() 。
。
⑺現有a.醋酸、b.鹽酸、c.硫酸三種溶液,根據要求答題。
![]() 若它們物質的量濃度相等,它們的pH由大到小的關系為_______(用abc表示,下同)。
若它們物質的量濃度相等,它們的pH由大到小的關系為_______(用abc表示,下同)。
![]() 若它們的pH相等,它們物質的量濃度由大到小的關系為_____。
若它們的pH相等,它們物質的量濃度由大到小的關系為_____。
![]() 若它們的pH相等,均加水稀釋100倍后,其pH由大到小的關系為________。
若它們的pH相等,均加水稀釋100倍后,其pH由大到小的關系為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】人們認識最早的鹽是食鹽,![]() 尚書
尚書![]() 說命
說命![]() 記載:“若作和羹,爾惟鹽梅”,說明勞動人民在商代就已經知道用鹽配制美味的羹湯。而現代化學定義的鹽,具有更廣范圍和更深的涵義,探索它們的奧秘可以使我們更科學的利用它們。今對
記載:“若作和羹,爾惟鹽梅”,說明勞動人民在商代就已經知道用鹽配制美味的羹湯。而現代化學定義的鹽,具有更廣范圍和更深的涵義,探索它們的奧秘可以使我們更科學的利用它們。今對![]() 、
、![]() 、
、![]() 、
、![]() 四種常見的鹽進行探究。回答下列問題:
四種常見的鹽進行探究。回答下列問題:
⑴已知![]() 時,AgCl的溶度積為
時,AgCl的溶度積為![]() ,則AgCl在
,則AgCl在![]() 溶液中的
溶液中的![]() 為________
為________![]() 。
。
⑵![]() 時,
時,![]() 溶液的
溶液的![]() ,則關于該溶液中
,則關于該溶液中![]() 的說法正確的是________。
的說法正確的是________。
A.與m無關的定值 ![]() 與m有關的定值
與m有關的定值 ![]() 與
與![]() 有關的不定值
有關的不定值
⑶![]() 時,將
時,將![]() 溶液和
溶液和![]() 溶液各
溶液各![]() 混合,此時混合溶液的
混合,此時混合溶液的![]() ,則
,則![]() 的電離平衡常數
的電離平衡常數![]() ________
________![]() 用含n的表達式表示
用含n的表達式表示![]() 。
。
⑷將![]() 、生石灰和水按一定比例混合可得殺菌劑波爾多液,其有效成分為難溶的堿式硫酸銅
、生石灰和水按一定比例混合可得殺菌劑波爾多液,其有效成分為難溶的堿式硫酸銅![]() ,為測定其中x與y的比值,進行了如下實驗:取等質量的堿式硫酸銅樣品兩份,一份滴加稀硫酸至恰好完全溶解,消耗的硫酸為
,為測定其中x與y的比值,進行了如下實驗:取等質量的堿式硫酸銅樣品兩份,一份滴加稀硫酸至恰好完全溶解,消耗的硫酸為![]() ,另一份高溫灼燒后只得到
,另一份高溫灼燒后只得到![]() 固體。所得數據顯示
固體。所得數據顯示![]() ,則該堿式硫酸銅的化學式中
,則該堿式硫酸銅的化學式中![]() ________。
________。
⑸![]() 時,向
時,向![]() 溶液中逐滴加入
溶液中逐滴加入![]() 的鹽酸
的鹽酸![]() ,溶液的pH逐漸降低,此時溶液中含硫元素的微粒物質的量濃度的百分含量
,溶液的pH逐漸降低,此時溶液中含硫元素的微粒物質的量濃度的百分含量![]() 縱軸
縱軸![]() 也發生變化,如圖所示:
也發生變化,如圖所示:
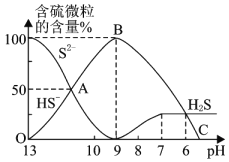
![]() 反應到A點時,溶液中的離子濃度大小的關系為________。
反應到A點時,溶液中的離子濃度大小的關系為________。
![]() 點對應的溶液中大量存在的溶質是________。
點對應的溶液中大量存在的溶質是________。
![]() 混合溶液的
混合溶液的![]() ________時,溶液中開始有
________時,溶液中開始有![]() 氣體放出。
氣體放出。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于化合物2苯基丙烯(![]() ),下列說法正確的是
),下列說法正確的是
A. 不能使稀高錳酸鉀溶液褪色
B. 可以發生加成聚合反應
C. 分子中所有原子共平面
D. 易溶于水及甲苯
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com