
【題目】某化學學習小組進行如下實驗測定 H2C2O4·xH2O 中 x 值已知:M(H2C2O4)=90gmol-1
① 稱取1.260 g 純草酸晶體,將草酸制成 100.00 mL 水溶液為待測液;
② 取25.00 mL 待測液放入錐形瓶中,再加入適量的稀 H2SO4;
③ 用濃度為 0.05 000 mol·L-1 的 KMnO4標準溶液進行滴定。
(1)請寫出滴定中發生反應的離子方程式________________________。
(2)某學生的滴定方式(夾持部分略去)如下,最合理的是_____(選填 a、b)。
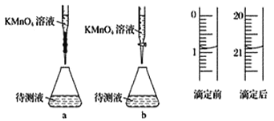
(3)由圖可知消耗 KMnO4 溶液體積為________mL。
(4)滴定過程中眼睛應注視_______________,滴定終點錐形瓶內溶液的顏色變化為_______。
(5)通過上述數據,求得 x=_____。
a.若由于操作不當,滴定結束后滴定管尖嘴處有一氣泡, 引起實驗結果_____(填“偏大”、“偏小”或“無影響”);
b.若在接近終點時,用少量蒸餾水將錐形瓶沖洗一下,再繼續滴定至終點,則所測結果_______(填“偏大”、“偏小”或“無影響”);
c.若在達到滴定終點時仰視讀數,則所得結果________(填“偏大”、“偏小”或“無影響”);
d.若其它操作均正確,滴定前未用標準 KMnO4 溶液潤洗滴定管,引起實驗結果_________(填“偏大”、“偏小”或“無影響”)。
【答案】5H2C2O4+2MnO4- +6H+ ===10CO2 ↑+2Mn2+ +8H2O b 20.00 錐形瓶中顏色變化 溶液由無色變成紫紅色,且半分鐘內不褪色 2 偏小 無影響 偏大 偏大
【解析】
(1)H2C2O4溶液和酸性KMnO4溶液反應生成二氧化碳、錳離子和水;
(2)據高錳酸鉀呈酸性,盛放在酸式滴定管中來選擇;
(3)根據滴定管的結構、精確度以及測量原理來解答;
(4)據滴定終點的判斷是溶液中顏色的變化來分析;
(5)據此6H++5H2C2O4+2MnO4-=2Mn2++10CO2↑+8H2O離子方程式來計算;據滴定過程中眼睛應注視溶液中顏色變化,來判斷滴定終點分析;根據 c(待測)=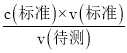 分析不當操作對V(標準)的影響,以此判斷濃度的誤差。
分析不當操作對V(標準)的影響,以此判斷濃度的誤差。
(1)H2C2O4溶液和酸性KMnO4溶液反應生成二氧化碳、錳離子和水,其反應的離子方程式為:6H++5H2C2O4+2MnO4-=2Mn2++10CO2↑+8H2O;
(2)高錳酸鉀溶液呈酸性,應盛放在酸式滴定管中,故答案為b;
(3)該儀器是酸式滴定管,滴定管滴定前后讀數為:0.80mL,20.80mL,消耗KMnO4溶液體積為20.80mL-0.80mL=20.00mL;
(4)據酸性KMnO4溶液為紫紅色,滴定終點時無色變為紫紅色,且半分鐘不褪色為滴定到終點故眼睛應注視溶液中顏色變化;
(5)6H++5H2C2O4+2MnO4-=2Mn2++10CO2↑+8H2O
5 2
n=0.00250.02×0.05
m(H2C2O4)=0.0025×90=0.225g;m(H2C2O4xH2O )=1.26×![]() =0.315g;
=0.315g;
m(H2O)=0.315-0.225=0.09g;n(H2O)=![]() mol=0.005mol①
mol=0.005mol①
又因為 n H2C2O4)=0.0025 mol根據元素守恒即n(H2C2O4xH2O )=0.0025mol;n(H2O)=0.0025x②;聯立①②得0.005=0.0025x,解得x=2;
a. 滴定結束后滴定管尖嘴處有一氣泡,消耗標準液的體積偏小,根據 c(待測)=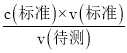 ,導致測定結果偏小;
,導致測定結果偏小;
b.若在接近終點時,用少量蒸餾水將錐形瓶沖洗一下,再繼續滴定至終點,不影響消耗標準溶液的體積,根據 c(待測)=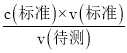 ,則測定結果無影響;
,則測定結果無影響;
c.若在達到滴定終點時仰視讀數,造成V(標準)偏大,根據 c(待測)=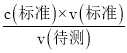 故c(待測)偏大;
故c(待測)偏大;
d.未用標準KMnO4溶液潤洗滴定管,溶液被稀釋,造成V(標準)偏大,根據 c(待測)=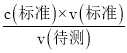 故c(待測)偏大;
故c(待測)偏大;


 舉一反三同步巧講精練系列答案
舉一反三同步巧講精練系列答案 口算與應用題卡系列答案
口算與應用題卡系列答案科目:高中化學 來源: 題型:
【題目】(1)基態溴原子的價層電子軌道排布式為________。第四周期中,與溴原子未成對電子數相同的金屬元素有_______種。
(2)鈹與鋁的元素性質相似。下列有關鈹和鋁的敘述正確的有___________(填標號)。
A.都屬于p區主族元素B.電負性都比鎂大
C.第一電離能都比鎂大D.氯化物的水溶液pH均小于7
(3)Al元素可形成[AlF6]3-、[AlCl4]-配離子,而B元素只能形成[BF4]-配離子,由此可知決定配合物中配位數多少的因素是________________;[AlCl4]-的立體構型名稱為______。
(4)P元素有白磷、紅磷、黑磷三種常見的單質。
①白磷(P4)易溶于CS2,難溶于水,原因是________________
②黑磷是一種黑色有金屬光澤的晶體,是一種比石墨烯更優秀的新型材料。白磷、紅磷都是分子晶體,黑磷晶體與石墨類似的層狀結構,如圖所示。下列有關黑磷晶體的說法正確的是_________。

A.黑磷晶體中磷原子雜化方式為sp2雜化
B.黑磷晶體中層與層之間的作用力是分子間作用力
C.黑磷晶體的每一層中磷原子都在同一平面上
D.P元素三種常見的單質中,黑磷的熔沸點最高
(5)F2中F-F鍵的鍵能(157kJ/mol)小于Cl2中Cl-Cl鍵的鍵能(242.7kJ/mol),原因是_________。
(6)金屬鉀的晶胞結構如圖。若該晶胞的密度為a g/cm3,阿伏加得羅常數為NA,則表示K原子半徑的計算式為______。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A. 丙烯分子中所有原子均在同一平面上
B. ![]() 命名為2-甲基-3-丁炔
命名為2-甲基-3-丁炔
C. 化合物![]() 不是苯的同系物
不是苯的同系物
D. C5H12的同分異構體數目與甲苯的一氯代物數目相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有四種短周期主族元素z、e、g、h,其最高價氧化物對應水化物溶液(濃度均為0.01molL﹣1)的pH與原子序數的關系如圖所示。下列說法正確的是

A. 離子半徑大小 e>g>h
B. g位于第三周期VA族
C. e2g2中即含有離子鍵有含有非極性共價鍵
D. 同濃度簡單氫化物水溶液的pH值 h >g> z
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某班同學用如下實驗探究Fe2+、Fe3+和FeO42-的性質。
資料:K2FeO4為紫色固體,微溶于KOH溶液;具有強氧化性,在酸性或中性溶液中快速產生O2,在堿性溶液中較穩定。回答下列問題:
(1)分別取一定量氯化鐵、氯化亞鐵固體,均配制成0.1mol/L的溶液。在FeCl2溶液中需加入少量鐵屑,其目的是________;將FeCl3晶體溶于濃鹽酸,再稀釋到需要的濃度,鹽酸的作用是________。
(2)制備K2FeO4(夾持裝置略)后,取C中紫色溶液,加入稀硫酸,產生黃綠色氣體,得溶液a,經檢驗氣體中含有Cl2。為證明是否K2FeO4氧化了Cl-而產生Cl2,設計以下方案:
方案Ⅰ | 取少量a,滴加KSCN溶液至過量,溶液呈紅色。 |
方案Ⅱ | 用KOH溶液充分洗滌C中所得固體,再用KOH溶液將K2FeO4溶出,得到紫色溶液b。取少量b,滴加鹽酸,有Cl2產生。 |
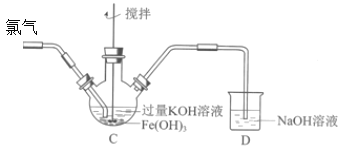
Ⅰ.由方案Ⅰ中溶液變紅可知a中含有______離子,但該離子的產生不能判斷一定是K2FeO4將Cl-氧化,還可能由________________產生(用方程式表示)。
Ⅱ.方案Ⅱ可證明K2FeO4氧化了Cl-。用KOH溶液洗滌的目的是________________。根據K2FeO4的制備原理3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O得出:氧化性Cl2______FeO42-(填“>”或“<”),而方案Ⅱ實驗表明,Cl2和FeO42-的氧化性強弱關系相反,原因是________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】明礬石是制取鉀肥和氫氧化鋁的重要原料,明礬石的組成和明礬相似,此外還含有氧化鋁和少量氧化鐵雜質。具體實驗步驟如下圖所示(明礬石焙燒后成分不變):
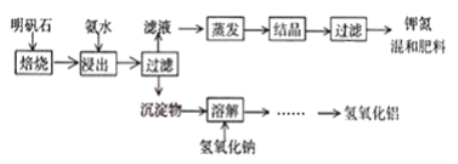
完成下列填空:
(1)“浸出”反應的離子方程式為_______。“浸出”所用稀氨水濃度為39.20g/L,配制500mL該氨水需251.28g/L的濃氨水________mL。
(2)“過濾”所需的玻璃儀器有______________。
(3)寫出“溶解”過程中發生反應的化學方程式_________、________。
(4)檢驗濾液中是否含有SO42-的實驗方法__________。
(5)為測定鉀氨復合肥K2SO4、(NH4)2SO4中SO42-的質量分數,設計實驗步驟如下:
①_____________________。
②溶于水,加入足量BaCl2溶液,待白色沉淀不再產生為止。
③過濾、______、________(依次填寫實驗操作名稱)。
④冷卻、稱量所得沉淀的質量。
(6)若所取試樣和所得沉淀的質量分別為mg、ng,試用含有m、n的代數式表示該鉀氮復合肥中SO42-的質量分數為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】能源問題是人類社會面臨的重大課題,甲醇是未來重要的綠色能源之一。
(1)利用工業廢氣CO2可制取甲醇,已知常溫常壓下下列反應的能量關系如圖:
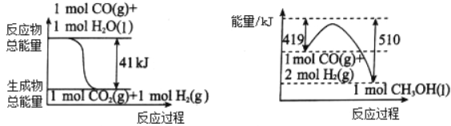
則CO2與H2反應生成CH3OH的熱化學方程式為_____________________
(2)CH4和H2O(g)通過下列轉化也可以制得CH3OH;
I.CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1>0
CO(g)+3H2(g) △H1>0
Ⅱ.CO(g)+2H2(g)![]() CH3OH(g) △H2<0
CH3OH(g) △H2<0
將1.0molCH4和3.0molH2O(g)通入反應室(容積為100L)中,在一定條件下發生反應I,CH4的轉化率與溫度、壓強的關系如下圖所示。
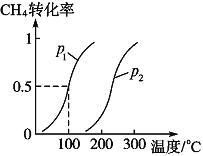
①已知溫度為T1℃時達到平衡所需的時間為5min,則用H2表示的平均反應速率為________;
②圖中的p1_______p2(填“<”、“>”或“=”),判斷的理由是________________________。
③若反應Ⅱ在恒容密閉容器進行,下列能判斷反應Ⅱ達到平衡狀態的是_________(填序號)。
a.生成CH3OH的速率與消耗CO的速率相等
b.混合氣體的密度不變
c.混合氣體的總物質的量不變
d.CH3OH、CO、H2的濃度都不再發生變化
④在某溫度下,將一定量的CO和H2投入10L的密閉容器中發生反應II,5min時達到平衡,各物質的物質的濃度(mol·L﹣1)變化如下表所示:
2min | 5min | 10min | |
CO | 0.07 | 0.06 | 0.05 |
H2 | 0.14 | 0.12 | 0.20 |
CH3OH | 0.03 | 0.04 | 0.05 |
若5min時只改變了某一條件,則所改變的條件是_____________;10min時測得各物質濃度如表,10min時v正_______v逆(填“<”、“>”或“=”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】體育競技中服用興奮劑既有失公平,也敗壞了體育道德。某種興奮劑的結構簡式如圖所示。有關該物質的說法中正確的是( )
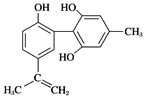
A. 該物質遇FeCl3溶液呈紫色,且屬于苯酚同系物
B. 滴入酸性KMnO4溶液振蕩,紫色褪去,能證明其結構中存在碳碳雙鍵
C. 1 mol該物質分別與濃溴水和H2反應時最多消耗Br2和H2分別為4 mol和7 mol
D. 該分子中所有碳原子一定共平面
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com