
 N2O5是一種新型硝化劑,其性質和制備受到人們的關注.
N2O5是一種新型硝化劑,其性質和制備受到人們的關注.| t/s | 0 | 500 | 1 000 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.48 |
分析 (1)①反應達平衡后,再通入一定量N2O5,等效為增大壓強,平衡逆向移動;
②根據v=$\frac{△c}{△t}$計算v(N2O5);
③若T2溫度高,反應速率快,未到達平衡時,相同時間內N2O5的濃度減小更大,正反應為吸熱反應,到達平衡時溫度升高,平衡正向移動,N2O5的濃度會減小.而在T2溫度下,反應1000s時測得NO2的濃度為4.98mol•L-1,則此時N2O5的濃度為5mol/L-$\frac{1}{2}$×4.98mol•L-1=2.51mol/L,高于在T1溫度下1000s時測得N2O5的濃度,說明T2溫度下反應速率較慢;
(2)由N2O4制取N2O5需要是去電子,所以N2O5在陽極區生成,在硝酸參與下生成N2O5與氫離子.
解答 解:(1)①反應達平衡后,再通入一定量N2O5,等效為增大壓強,平衡逆向移動,N2O5的轉化率減小,
故答案為:減小;
②由表中數據可知,500s內N2O5的濃度變化量為5mol/L-3.52mol/L=1.48mol/L,故N2O5的分解速率為$\frac{1.48mol/L}{500s}$=0.00296 mol•L-1•s-1,
故答案為:0.00296 mol•L-1•s-1;
③若T2溫度高,反應速率快,未到達平衡時,相同時間內N2O5的濃度減小更大,正反應為吸熱反應,到達平衡時溫度升高,平衡正向移動,N2O5的濃度會減小.而在T2溫度下,反應1000s時測得NO2的濃度為4.98mol•L-1,則此時N2O5的濃度為5mol/L-$\frac{1}{2}$×4.98mol•L-1=2.51mol/L,高于在T1溫度下1000s時測得N2O5的濃度,說明T2溫度下反應速率較慢,故溫度T2<T1,
故答案為:<;
(2)從電解原理來看,N2O4制備N2O5為氧化反應,則N2O5應在陽極區生成,在硝酸參與下生成N2O5與氫離子,電極反應式為:N2O4+2HNO3-2e-═2N2O5+2H+,
故答案為:陽極;N2O4+2HNO3-2e-═2N2O5+2H+.
點評 本題考查化學平衡計算與影響因素、化學反應速率計算、電化學等知識點,(2)中③學生容易考慮反應速率問題,忽略是否到發生平衡移動,難度中等.


 A加金題 系列答案
A加金題 系列答案 全優測試卷系列答案
全優測試卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | 檢驗NH4+時,加濃NaOH溶液,加熱,用濕潤的紅色石蕊試紙放在試管口檢驗,若試紙變藍,則可證明原溶液中含有NH4+ | |
| B. | 檢驗SO42-時,加入BaCl2溶液,再加稀硝酸,若沉淀不消失,則可證明含SO42- | |
| C. | 用天平和小燒杯稱量5.40gNaOH固體 | |
| D. | 用飽和FeCl3溶液中逐滴滴加NaOH溶液,至溶液呈紅褐色即可制得Fe(OH)3膠體 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 現有A、B、C、D、E、F六種短周期元素,它們的原子序數依次增大,D與E的氫化物分子構型都是V型.A、B的最外層電子數之和與C的最外層電子數相等,A能分別與B、C形成電子總數相等的分子,且A與D可形成的化合物,常溫下均為液態.
現有A、B、C、D、E、F六種短周期元素,它們的原子序數依次增大,D與E的氫化物分子構型都是V型.A、B的最外層電子數之和與C的最外層電子數相等,A能分別與B、C形成電子總數相等的分子,且A與D可形成的化合物,常溫下均為液態.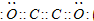 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 使酚酞變紅色的溶液中:Na+、Al3+、SO42-、Cl- | |
| B. | Kw/c(OH-)=1×10-13mol•L-1的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| C. | 與Al反應能放出H2的溶液中:Fe2+、K+、NO3-、SO42- | |
| D. | c(H+)=1×10-13mol•L-1的溶液中:K+、Na+、AlO2-、CO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 溫度/℃ | 4 | 18 | 75 |
| 溶解度/[g•(100gH2O)-1] | 0.18 | 0.27 | 2.2 |
 (用化學方程式表示).
(用化學方程式表示).查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com