
(8分)把煤作為燃料可通過下列兩種途徑:
途徑I:C(s) +O2 (g)=CO2(g) △H1<0 ①
途徑II:先制成水煤氣:C(s) +H2O(g)=CO(g)+H2(g) △H2>0 ②
再燃燒水煤氣:2CO(g)+O2 (g)=2CO2(g) △H3<0 ③
2H2(g)+O2 (g)=2H2O(g) △H4<0 ④
請回答下列問題:
(1)途徑I放出的熱量 ( 填“大于”“等于”或“小于”) 途徑II放出的熱量。
(2)△H1、△H2、△H3、△H4的數學關系式是 。
(3)12g炭粉在氧氣中不完全燃燒生成一氧化碳,放出110.35kJ熱量。其熱化學方程式為 。
(4)煤炭作為燃料采用途徑II的優點有 。
(1)等于 (2)ΔH1=ΔH2+1/2(ΔH3+ΔH4) (3)C(s) +!/2O2(g)=CO(g) ΔH=-110.35KJ/mol (4)燃料燃燒充分,利用率高,放熱多,污染少。
解析試題分析:化學反應產生的熱量的多少只與物質的起始狀態和終了狀態有關,而與反應途徑無關。如果起始狀態和終了狀態相同,則放出的熱量也就相同。ΔH1=ΔH2+1/2(ΔH3+ΔH4).12g 炭粉在氧氣中不完全燃燒生成一氧化碳,放出110.35kJ熱量。其熱化學方程式為:C(s) +!/2O2(g)=CO(g) ΔH=-110.35KJ/mol。煤炭作為燃料采用途徑II可以使燃料充分燃燒,燃料的利用率高,放出熱量多,污染也少。更清潔環保。
考點:考查蓋斯定律的應用。


 第1卷單元月考期中期末系列答案
第1卷單元月考期中期末系列答案科目:高中化學 來源: 題型:填空題
二甲醚(CH3OCH3)是無色氣體,可作為一種新型能源,由合成氣(組成為H2、CO、和少量CO2)直接制備二甲醚,其中主要過程包括以下四個反應(均為可逆反應):
①CO(g)+ 2H2(g) = CH3OH(g) △H1=—90.1 kJ·mol-1
②CO2(g)+ 3H2(g) = CH3OH(g)+H2O(g) △H2=—49.0 kJ·mol-1
水煤氣變換反應③CO(g) + H2O (g)=CO2(g)+H2(g) △H3=—41.1 kJ·mol-1
二甲醚合成反應④2CH3OH(g)=CH3OCH3(g)+H2O(g) △H4=—24.5 kJ·mol-1
(1)由H2和CO直接制備二甲醚(另一產物為水蒸氣)的熱化學方程式為 。
(2)一定溫度下,在恒容密閉容器中進行反應①,下列描述能說明反應到達平衡狀態的是 。
a.容器中氣體平均相對分子質量保持不變
b.容器中氣體密度保持不變
c.CH3OH(g)濃度保持不變
d.CH3OH(g)的消耗速率等于H2 (g)的消耗速率
(3)一定溫度下,將8mol CH3OH(g)充入5L密閉容器中進行反應④,一段時間后到達平衡狀態,反應過程中共放出49kJ熱量,則CH3OH(g)的平衡轉化率為 ,該溫度下,平衡常數K= ;該溫度下,向容器中再充入2mol CH3OH(g),對再次達到的平衡狀態的判斷正確的是 。
a.CH3OH(g)的平衡轉化率減小
b.CH3OCH3 (g)的體積分數增大
c.H2O(g)濃度為0.5mol·L-1
d.容器中的壓強變為原來的1.25倍
(4)二甲醚—氧氣燃料電池具有啟動快,效率高等優點,其能量密度高于甲醇燃料電池,若電解質為酸性,二甲醚—氧氣燃料電池的負極反應為 ;消耗2.8L(標準狀況)氧氣時,理論上流經外電路的電子 mol
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
過度排放CO2會造成“溫室效應”,為了減少煤燃燒對環境造成的污染,煤的氣化是高效、清潔利用煤炭的重要途徑。煤綜合利用的一種途徑如圖所示。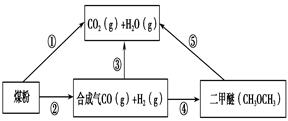
(1)已知①C(s) + H2O(g) = CO(g)+H2(g) ΔH1=+131.3 kJ·mol-1
②C(s) + 2H2O(g) = CO2(g) + 2H2(g) ΔH2=+90 kJ·mol-1
則一氧化碳與水蒸氣反應生成二氧化碳和氫氣的熱化學方程式是 ________________________,
(2)用下圖原電池裝置可以完成過程⑤的轉化,該裝置b電極的電極反應式是_______________________。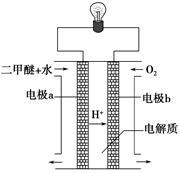
(3)在壓強為0.1 MPa條件下,容積為V L的密閉容器中a mol CO與2a mol H2在催化劑作用下反應生成甲醇:
CO(g)+2H2(g)  CH3OH(g),CO的平衡轉化率與溫度、壓強的關系如下圖所示,則:
CH3OH(g),CO的平衡轉化率與溫度、壓強的關系如下圖所示,則: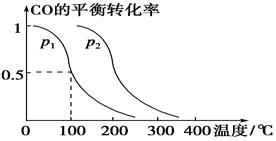
①p1________p2(填“>”、“<”或“=”)。
②在其他條件不變的情況下,向容器中再增加a mol CO與2a mol H2,達到新平衡時,CO的平衡轉化率________(填“增大”、“減小”或“不變”)。
③在p1下,100 ℃時,CO(g)+2H2(g)  CH3OH(g)反應的平衡常數為________(用含a、V的代數式表示)。
CH3OH(g)反應的平衡常數為________(用含a、V的代數式表示)。
(4)如圖表示CO2與H2反應生成CH3OH和H2O的過程中能量(單位為kJ·mol-1)的變化: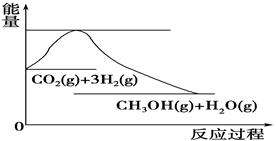
關于該反應的下列說法中,正確的是________(填編號)。
A.ΔH>0,ΔS>0 B.ΔH>0,ΔS<0
C.ΔH<0,ΔS<0 D.ΔH<0,ΔS>0
(5)為探究反應原理,現進行如下實驗,在體積為1 L的密閉容器中,充入1 mol CO2和3 mol H2,一定條件下發生反應:CO2(g)+3H2(g)  CH3OH(g)+H2O(g),測得CO2(g)和CH3OH(g)的濃度隨時間變化的曲線如圖所示:
CH3OH(g)+H2O(g),測得CO2(g)和CH3OH(g)的濃度隨時間變化的曲線如圖所示: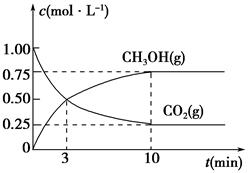
①從反應開始到平衡,CO2的平均反應速率v(CO2)=________。
②下列措施中能使化學平衡向正反應方向移動的是________(填編號)。
A.升高溫度 B.將CH3OH(g)及時液化移出
C.選擇高效催化劑 D.再充入1 mol CO2和3 mol H2
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(1) 8g液態的CH3OH在氧氣中完全燃燒,生成二氧化碳氣體和液態水時釋放出Q kJ的熱量。試寫出液態CH3OH燃燒熱的熱化學方程式 。
(2)在化學反應過程中,破壞舊化學鍵需要吸收能量,形成新化學鍵又會釋放能量。
| 化學鍵 | H—H | N—H | N≡N |
| 鍵能/kJ·mol-1 | 436 | 391 | 945 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
已知:①溶液中CrO42—顯黃色,Cr2O72-顯橙紅色
②PbCrO4難溶于水,也難溶于強酸
③H+(aq)+OH-(aq)=H2O(l); ΔH=" —a" KJ/mol
3Cl2(g)+2Cr3+(aq)+16OH-(aq)=2CrO42-(aq)+6Cl-(aq)+8H2O(l);ΔH="—b" KJ/mol
2CrO42-(aq)+2H+(aq)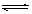 Cr2O72-(aq)+H2O(l);ΔH="—c" KJ/mol
Cr2O72-(aq)+H2O(l);ΔH="—c" KJ/mol
平衡常數K=9.5×104 (上述a、b、c均大于0)
對上述反應⑤,取50mL溶液進行試驗,部分測定數據如下:
| 時間(s) | 0 | 0.01 | 0.02 | 0.03 | 0.04 |
| n (CrO42—)(mol) | 0.01 | 8.0×10-4 | 5.4×10-4 | 5.0×10-4 | |
| n (Cr2O72—)(mol) | 0 | | 4.73×10-3 | | 4.75×10-3 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
把煤作為燃料可通過下列兩種途徑:
途徑I:C(s) +O2 (g) == CO2(g) △H1<0 ①
途徑II:先制成水煤氣:C(s) +H2O(g) == CO(g)+H2(g) △H2>0 ②
再燃燒水煤氣:2CO(g)+O2 (g) == 2CO2(g) △H3<0 ③
2H2(g)+O2 (g) == 2H2O(g) △H4<0 ④
請回答下列問題:
(1) 途徑I放出的熱量 ( 填“大于”“等于”或“小于”) 途徑II放出的熱量。
(2) △H1、△H2、△H3、△H4的數學關系式是 。
(3)12g炭粉在氧氣中不完全燃燒生成一氧化碳,放出110.35kJ熱量。其熱化學方程式為 。
(4)煤炭作為燃料采用途徑II的優點有
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(1)在298K時,1molC2H6在氧氣中完全燃燒生成二氧化碳和液態水放出熱量1558.3 kJ。寫出該反應的熱化學方程式 。
(2)利用該反應設計一個燃料電池:用氫氧化鉀溶液作電解質溶液,多孔石墨做電極,在電極上分別
通入乙烷和氧氣。通入乙烷氣體的電極應為 極(填寫“正”“負”)該電極上發生的電極反應
式是
(3)如圖所示實驗裝置中,石墨棒上的電極反應式為 ;如果起始時盛有1000mLpH=5的硫酸銅溶液(25℃,CuSO4足量),一段時間后溶液的pH變為1,此時若要使溶液恢復到起始濃度(溫度不變,忽略溶液體積的變化),可向溶液中加入 __________(填物質名稱)。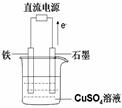
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(1)CH4(g )+2O2(g )=CO2(g )+2H2O(g ) ΔH=-802.3kJ/mol
該熱化學反應方程式的意義是_____________________________________。
(2)已知2g乙醇完全燃燒生成液態水放出Q kJ的熱量,寫出表示乙醇燃燒熱的熱化學方
程式:____________________________________________________________.
(3)已知拆開1mol H-H鍵,1mol N-H鍵,1mol 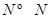 鍵分別需要的能量是436kJ、391KJ、946kJ,則N2與H2反應生成1mol NH3(g)的熱化學方程式是___________________.
鍵分別需要的能量是436kJ、391KJ、946kJ,則N2與H2反應生成1mol NH3(g)的熱化學方程式是___________________.
(4)依據蓋斯定律可以對某些難以通過實驗直接測定的化學反應的焓變進行推算。
已知:C(石墨,s)+O2(g)=CO2(g) ΔH=-393.5kJ/mol ①
2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ/mol ②
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH=-2599kJ/mol ③
根據蓋斯定律,計算298K時由C(石墨,s)和H2(g)生成1mol C2H2(g)反應的焓變:
____________________________.
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
氨氣是生產化肥、硝酸等的重要原料,圍繞合成氨人們進行了一系列的研究
(1)氫氣既能與氮氣又能與氧氣發生反應,但是反應的條件卻不相同。
已知:2H2 (g) + O2 (g) = 2H2O (g) ΔH =" -483.6" kJ/mol
3H2 (g) + N2 (g)  2NH3 (g) ΔH =" -92.4" kJ/mol
2NH3 (g) ΔH =" -92.4" kJ/mol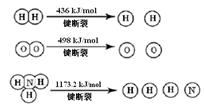
計算斷裂1 mol N≡N鍵需要能量 kJ , 氮氣分子中化學鍵比氧氣分子中的化學鍵鍵 (填“強”或“弱”),因此氫氣與二者反應的條件不同。
(2)固氮是科學家致力研究的重要課題。自然界中存在天然的大氣固氮過程:N2 (g) + O2 (g) =" 2NO" (g) ΔH =" +180.8" kJ/mol ,工業合成氨則是人工固氮。
分析兩種固氮反應的平衡常數,下列結論正確的是 。
| 反應 | 大氣固氮 | 工業固氮 | ||||
| 溫度/℃ | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.507 | 0.152 |
 2NH3 (g)測得甲容器中H2的轉化率為40%。
2NH3 (g)測得甲容器中H2的轉化率為40%。| | N2 | H2 | NH3 |
| 甲 | 1 | 3 | 0 |
| 乙 | 0.5 | 1.5 | 1 |
| 丙 | 0 | 0 | 4 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com