
【題目】汽車的啟動電源常用鉛蓄電池。其結構如下圖所示,放電時的電池反應如下:PbO2+Pb+2H2SO4===2PbSO4+2H2O根據此反應判斷下列敘述中正確的是( )

A. PbO2是電池的負極
B. SO42-向Pb極移動
C. PbO2得電子,被氧化
D. 電池放電時,溶液酸性增強
科目:高中化學 來源: 題型:
【題目】最近科學家冶煉出純度高達99.9999%的鐵。你估計它不會具有的性質是
A. 硬度比生鐵低 B. 與4mol/L的HCl反應時速率比生鐵快
C. 在冷的濃硫酸中可鈍化 D. 在潮濕的空氣中不易生銹
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在特制漏斗中將鋁熱劑混合均勻后,引發鋁熱反應的操作是:____________。
(2)硅與鋁同周期.地殼里硅鋁的含量硅____________鋁(填>,<或=)。工業上制備金屬鋁的化學方程式是: ____________,工業上制備硅的化學方程式有:
a.SiO2+2C![]() Si(粗)+2CO
Si(粗)+2CO
b.SiO2+3C![]() SiC +2CO(副反應),
SiC +2CO(副反應),
c.Si(粗)+ 2C12![]() SiCl4
SiCl4
d.SiC14 + 2H2![]() Si+4HC1,
Si+4HC1,
某同學將氧化還原反應、非氧化還原反應及四大基本反應繪制成上圖,其中屬于上圖“2"區域的反應是____________ (填序號)。

(3)SiO2是硅酸鹽玻璃(Na2CaSi6O14)主要成分,Na2CaSi6O14也可寫成Na2OCaO6SiO2,鈉長石(NaAlSi3O8)的氧化物形式____________,長石是鋁硅酸鹽,不同類長石其氧原子的物質的量分數相同.由此可推知鈣長石的化學式為____________。
(4)某鋁合金由Al、Si、Cu、Mg組成。①稱取100g該鋁合金樣品,分成等質量的A、B兩份。向A 份加入足量NaOH溶液,B份加入足量的稀鹽酸。②待兩份反應物都充分反應之后,稱得濾渣質量相差1.60g,收集得到的兩份氣體的體積相差2240mL(標準狀況下)。則樣品中Si和Mg的物質的量分別是n(Si)____________和n(Mg)____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】HA、H2B是兩種弱酸,H2B+A-=HB-+HA, B2-+HA=HB-+A-則下列說法正確的是 ( )
A.H2B的電離方程式為:H2B![]() 2H+ + B2-
2H+ + B2-
B.結合質子能力由強到弱的順序為:B2->A->HB-
C.等物質的量濃度NaA、NaHB、Na2B三種鹽的水溶液,NaA堿性最強
D.等pH的HA、H2B兩種溶液中,水的電離出的氫離子前者大于后者
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用酸性含錳廢水(主要含Mn2+、Cl-、H+、Fe2+、Cu2+)可制備高性能磁性材料(MnCO3)及純凈的氯化銅晶體(CuCl22H2O)。工業流程如下:

已知:幾種金屬離子沉淀的pH如表
金屬離子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
開始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
完全沉淀的pH | 9.7 | 3.7 | 6.4 | 10.4 |
回答下列問題:
(1)過程①中,MnO2在酸性條件下可將Fe2+氧化為Fe3+,反應的離子方程式為
(2)過程②中,所得濾渣W的成分是 。
(3)過程③中,調pH=6.4目的是 。
(4)過程④中,若生成的氣體J可使澄清的石灰水變渾濁,則生成MnCO3反應的離子方程式是 。
(5)將濾渣Q溶解在過量的鹽酸中,經過 ,過濾、洗滌、低溫烘干,即可獲得純凈的氯化銅晶體(CuCl22H2O)。
(6)過程④中,298K、c(Mn2+)為1.05mol/L時,實驗測得MnCO3的產率與溶液pH、反應時間關系如右圖。
據圖中信息,你選擇的最佳pH是 ;理由是 。
(7)從濾液C可得到的副產品是 (填化學式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于有機化合物的說法正確的是
A.2-甲基丙烷也稱異丁烷
B.蔗糖和纖維素都屬于高分子化合物
C.苯使溴水褪色是因為發生了取代反應
D.C3H6O2有3種同分異構體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】由熔鹽電解法獲得的粗鋁含一定量的金屬鈉和氫氣,這些雜質可采用吹氣精煉法除去,產生的尾氣經處理后可用于鋼材鍍鋁。工藝流程如下:

(注:NaCl熔點為801℃;AlCl3在181℃升華)
(1)精煉前,需清除坩堝表面的氧化鐵和石英砂,防止精煉時它們分別與鋁發生置換反應產生新的雜質,相關的化學方程式為①________和②________。
(2)將Cl2連續通入坩堝中的粗鋁熔體,雜質隨氣泡上浮除去。氣泡的主要成分除Cl2外還含有________;固態雜質粘附于氣泡上,在熔體表面形成浮渣,浮渣中肯定存在________。
(3)在用廢堿液處理氣體A的過程中,所發生反應的離子方程式為________。
(4)鍍鋁電解池中,金屬鋁為________極,熔融鹽電鍍液中鋁元素和氯元素主要以AlCl和Al2Cl形式存在,鋁電極的主要電極反應式為___________________________。
(5)鋼材鍍鋁后,表面形成的致密氧化鋁膜能防止鋼材腐蝕,其原因是___________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種工業制備SrCl2·6H2O的生產流程如下:
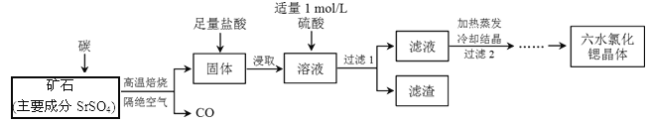
已知:①M(SrCl2·6H2O)=267 g/mol;
② Kap(SrSO4)= 3.3×10-7、Kap(BaSO4)=1.1×10-10;
③經鹽酸浸取后,溶液中除含有Sr2+和Cl-外,還含有少量Ba2+雜質。
(1)隔絕空氣高溫焙燒,若2 mol SrSO4中只有S被還原,轉移了16mol電子。寫出該反應的化學方程式:_____________________________________________。
(2)過濾2后還需進行的兩步操作是______、_________。
(3)加入硫酸的目的是_________________;為了提高原料的利用率,濾液中Sr2+的濃度應不高于_________ mol/L(注:此時濾液中Ba2+濃度為1×10-5 mol/L)。
(4)產品純度檢測:稱取1.000 g產品溶解于適量水中,向其中加入含AgNO3 1.100×10-2 mol的AgNO3溶液(溶液中除Cl―外,不含其它與Ag+反應的離子),待Cl―完全沉淀后,用含Fe3+的溶液作指示劑,用0.2000 mol/L的NH4SCN標準溶液滴定剩余的AgNO3,使剩余的Ag+ 以AgSCN白色沉淀的形式析出。
①滴定反應達到終點的現象是_______________________________。
②若滴定過程用去上述濃度的NH4SCN溶液20.00 mL,則產品中SrCl2·6H2O的質量百分含量為____________(保留4位有效數字)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在元素周期表的金屬元素和非金屬元素交界處,最容易找到的材料是( )
A. 制半導體的材料
B. 耐高溫、耐腐蝕的合金材料
C. 制農藥的材料
D. 制催化劑的材料
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com