
【題目】氮、碳氧化物的排放會對環境造成污染。多年來化學工作者對氮、碳的氧化物做了廣泛深入的研究并取得一些重要成果。
I.已知2NO(g)+O2(g)![]() 2NO2(g)的反應歷程分兩步:
2NO2(g)的反應歷程分兩步:
第一步:2NO(g)![]() N2O2(g) (快) H1<0;
N2O2(g) (快) H1<0;
v1正=k1正c2(NO) ;v1逆=k1逆c(N2O2)
第二步:N2O2(g)+O2(g)![]() 2NO2(g) (慢) H2< 0;
2NO2(g) (慢) H2< 0;
v2正=k2正c(N2O2)c(O2);v2逆=k2逆c2(NO2)
①在兩步的反應中,哪一步反應的活化能更大___(填“第一步”或“第二步”)。
②一定溫度下,反應2NO(g)+O2(g)![]() 2NO2(g)達到平衡狀態,請寫出用k1正、k1逆、k2正、k2逆表示的平衡常數表達式K=____________;
2NO2(g)達到平衡狀態,請寫出用k1正、k1逆、k2正、k2逆表示的平衡常數表達式K=____________;
II.(1)利用CO2和CH4重整不僅可以獲得合成氣(主要成分為CO、H2),還可減少溫室氣體的排放。已知重整過程中部分反應的熱化方程式為:
① CH4(g)=C(s)+2H2(g) ΔH1>0
② CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2>0
③ CO(g)+H2(g)=C(s)+H2O(g) ΔH3<0
則反應CH4(g)+CO2(g)=2CO(g)+2H2(g)的ΔH=______________________(用含 ΔH1 、ΔH2 、 ΔH3的代數式表示)若固定n(CO2)=n(CH4),改變反應溫度,CO2和CH4的平衡轉化率見圖甲。


同溫度下CO2的平衡轉化率大于CH4的平衡轉化率,原因是_________。
(2)在密閉容器中通入物質的量均為0.1mol的CH4和CO2,在一定條件下發生反應CO2(g) + CH4(g)![]() 2CO(g) + 2H2(g),CH4的平衡轉化率與溫度及壓強(單位Pa)的關系如圖乙所示。y點:v(正)_____v(逆)(填 “大于”“小于”或“等于”)。已知氣體分壓(p 分)=氣體總壓(p 總)× 氣體的物質的量分數。用平衡分壓代替平衡濃度可以得到平衡常數Kp,求x 點對應溫度下反應的平衡常數Kp=__________________。
2CO(g) + 2H2(g),CH4的平衡轉化率與溫度及壓強(單位Pa)的關系如圖乙所示。y點:v(正)_____v(逆)(填 “大于”“小于”或“等于”)。已知氣體分壓(p 分)=氣體總壓(p 總)× 氣體的物質的量分數。用平衡分壓代替平衡濃度可以得到平衡常數Kp,求x 點對應溫度下反應的平衡常數Kp=__________________。
III.根據2CrO42﹣+2H+ ![]() Cr2O72﹣+H2O設計如圖丙裝置(均為惰性電極)電解Na2CrO4溶液制取Na2Cr2O7,圖丙中左側電極連接電源的_________極,電解制備過程的總反應化學方程式為_________。測定陽極液中Na和Cr的含量,若Na與Cr的物質的量之比為a:b,則此時Na2CrO4的轉化率為_________。若選擇用熔融K2CO3作介質的甲烷(CH4)燃料電池充當電源,則負極反應式為________________。
Cr2O72﹣+H2O設計如圖丙裝置(均為惰性電極)電解Na2CrO4溶液制取Na2Cr2O7,圖丙中左側電極連接電源的_________極,電解制備過程的總反應化學方程式為_________。測定陽極液中Na和Cr的含量,若Na與Cr的物質的量之比為a:b,則此時Na2CrO4的轉化率為_________。若選擇用熔融K2CO3作介質的甲烷(CH4)燃料電池充當電源,則負極反應式為________________。
【答案】第二步 ![]() ΔH1 +ΔH2 -ΔH3 CO2發生了其他副反應 大于
ΔH1 +ΔH2 -ΔH3 CO2發生了其他副反應 大于 ![]() 負 4Na2CrO4+4H2O
負 4Na2CrO4+4H2O![]() 2Na2Cr2O7+4NaOH+2H2↑+O2↑ (2﹣
2Na2Cr2O7+4NaOH+2H2↑+O2↑ (2﹣![]() )×100% CH4﹣8e﹣+4CO32﹣=5CO2+2H2O
)×100% CH4﹣8e﹣+4CO32﹣=5CO2+2H2O
【解析】
Ⅰ. ①總反應的快慢由反應慢的一步決定,慢反應所需要的活化能更大,故答案為:第二步;
②因為反應達到平衡狀態,所以v1正=v1逆,v2正=v2逆,所以v1正v2正=v1逆v2逆,即k1正c2(NO)×k2正c(N2O2)c(O2)=k1逆c(N2O2)k2正c(N2O2),則![]() ,故答案為:
,故答案為:![]() ;
;
Ⅱ.(1)將已知的三個反應重新組合,反應1+2-3,得到反應CH4(g)+CO2(g)![]() 2CO(g)+2H2(g),根據蓋斯定律得ΔH=ΔH1 + ΔH2 - ΔH3,反應方程式中CH4和CO2的化學計量數之比為1:1,投料比也為1:1,因此二者轉化率應該相同,但是所給的轉化率圖像中,CO2轉化率曲線高于CH4轉化率曲線,可能是CO2發生了一些副反應造成的,故答案為:ΔH1 +ΔH2-ΔH3;CO2發生了其他副反應;
2CO(g)+2H2(g),根據蓋斯定律得ΔH=ΔH1 + ΔH2 - ΔH3,反應方程式中CH4和CO2的化學計量數之比為1:1,投料比也為1:1,因此二者轉化率應該相同,但是所給的轉化率圖像中,CO2轉化率曲線高于CH4轉化率曲線,可能是CO2發生了一些副反應造成的,故答案為:ΔH1 +ΔH2-ΔH3;CO2發生了其他副反應;
(2) 反應CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)是個氣體體積增大的反應,壓強越大,CH4的轉化率越小,由圖可知相同溫度下,P1條件下的轉化率大于P2,則P1小于P2,壓強為P2時,在Y點反應未達到平衡,則反應正向移動,所以v(正)>v(逆),由圖可知該溫度下X所處條件下的平衡時甲烷的轉化率為50%,則有:
2CO(g)+2H2(g)是個氣體體積增大的反應,壓強越大,CH4的轉化率越小,由圖可知相同溫度下,P1條件下的轉化率大于P2,則P1小于P2,壓強為P2時,在Y點反應未達到平衡,則反應正向移動,所以v(正)>v(逆),由圖可知該溫度下X所處條件下的平衡時甲烷的轉化率為50%,則有:
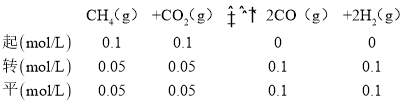
總物質的量=0.3mol,總壓為P2,其平衡常數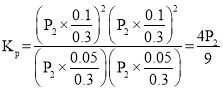 ,故答案為:大于;
,故答案為:大于;![]() ;
;
Ⅲ. 根據2CrO42-+2H+===Cr2O72-+H2O,電解Na2CrO4溶液制取Na2Cr2O7,應在酸性條件下進行,即右側電極生成H+,則消耗OH-,發生氧化反應,右側為陽極,則左側為陰極,電解電源的負極,電解制備過程的總反應方程式為4Na2CrO4+4H2O![]() 2Na2Cr2O7+4NaOH+2H2↑+O2↑,設加入反應容器內的Na2CrO4為1mol,反應過程中有x mol Na2CrO4轉化為Na2Cr2O7,則陽極區剩余Na2CrO4為(1-x)mol,對應的n(Na)=2(1-x)mol,n(Cr)=(1-x)mol,生成的Na2Cr2O7為
2Na2Cr2O7+4NaOH+2H2↑+O2↑,設加入反應容器內的Na2CrO4為1mol,反應過程中有x mol Na2CrO4轉化為Na2Cr2O7,則陽極區剩余Na2CrO4為(1-x)mol,對應的n(Na)=2(1-x)mol,n(Cr)=(1-x)mol,生成的Na2Cr2O7為![]() mol,對應的n(Na)=x mol,n(Cr)=x mol,根據Na與Cr的物質的量之比為a:b,解得x=
mol,對應的n(Na)=x mol,n(Cr)=x mol,根據Na與Cr的物質的量之比為a:b,解得x=![]() ,轉化率為
,轉化率為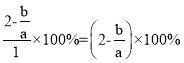 。
。
若選擇用熔融K2CO3作介質的甲烷燃料電池充當電源,則負極反應式為CH4﹣8e﹣+4CO32﹣=5CO2+2H2O,故答案為;負;4Na2CrO4+4H2O![]() 2Na2Cr2O7+4NaOH+2H2↑+O2↑;(2﹣
2Na2Cr2O7+4NaOH+2H2↑+O2↑;(2﹣![]() )×100%;CH4﹣8e﹣+4CO32﹣=5CO2+2H2O。
)×100%;CH4﹣8e﹣+4CO32﹣=5CO2+2H2O。


科目:高中化學 來源: 題型:
【題目】我國在太陽能光電催化-化學耦合分解硫化氫研究中獲得新進展,相關裝置如圖所示。下列說法正確的是(已知質子交換膜只允許H+通過)( )

A.該制氫工藝中光能最終轉化為化學能
B.該裝置工作時,H+由b極區流向a極區
C.a極上發生的電極反應為Fe3++e-=Fe2+
D.a極區需不斷補充含Fe3+和Fe2+的溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組中的反應,屬于同一反應類型的是
A. 由溴丙烷水解制丙醇;由丙烯與水反應制丙醇
B. 由甲苯硝化制對硝基甲苯;由甲苯氧化制苯甲酸
C. 由氯代環己烷消去制環己烯;由丙烯加溴制![]() 二溴丙烷
二溴丙烷
D. 由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】重要的農藥、醫藥中間體-堿式氯化銅[CuaClb(OH)c·xH2O],可以通過以下步驟制備。步驟 1:將銅粉加入稀鹽酸中,并持續通空氣反應生成 CuCl2。已知Fe3+對該反應有催化作用,其催化原理如圖所示。步驟2:在制得的CuCl2溶液中,加入石 灰乳充分反應后即可制備堿式氯化銅。下列有關說法不正確的是

A.圖中M、N分別為Fe2+、Fe3+
B.a、b、c 之間的關系式為:2a=b+c
C.步驟1充分反應后,加入少量CuO是為了除去Fe3+
D.若制備1 mol的CuCl2,理論上消耗標況下11.2 LO2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)在有機化學中廣泛采用系統命名法,根據系統命名法原則,回答下列問題:
① 系統命名法命名下列物質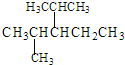 __________;
__________;
② 3,4-二甲基-2-戊烯的結構簡式是_____________;
(2)![]() 中含有的官能團的名稱為________。
中含有的官能團的名稱為________。
(3)按要求書寫下列化學方程式:
①甲苯制備TNT_____________;
②實驗室制備乙炔______________。
(4)下列物質的沸點按由高到低的順序排列正確的是_______。
①CH3(CH2)2CH3 ②CH3(CH2)3CH3 ③(CH3)3CH ④(CH3)2CHCH2CH3
A ④③②① B ②④③① C ②④①③ D ④②①③
(5)現有下列6種與人們生產生活相關的有機物:①CH3COOH(調味劑) ②HCOOCH3(煙草熏蒸劑)③![]() (制酚醛樹脂)④
(制酚醛樹脂)④ (生產殺蟲劑)⑤CH2=CH─CH=CH2(合成橡膠原料)⑥HCHO(防腐劑)。 其中與①互為同分異構體的是________________(填序號)。
(生產殺蟲劑)⑤CH2=CH─CH=CH2(合成橡膠原料)⑥HCHO(防腐劑)。 其中與①互為同分異構體的是________________(填序號)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用兩種不飽和烴A和D為原料可以合成一類新藥有機物J ,合成路線如下:

已知①
②有機物J結構中含兩個環。
回答下列問題:
(1)C的名稱是________________。
(2)A→B試劑和反應條件為________________。
(3)H→J的化學反應方程式為_______________。
(4)已知![]() 符合下列條件的 N的同分異構體有___________種,其中核磁共振氫譜顯示環上只有 3 組峰,且峰面積之比為 4:4:1,寫出符合條件一種同分異構體的結構簡式____________。
符合下列條件的 N的同分異構體有___________種,其中核磁共振氫譜顯示環上只有 3 組峰,且峰面積之比為 4:4:1,寫出符合條件一種同分異構體的結構簡式____________。
①含有基團![]() 、環上有三個取代基②與NaHCO3反應產生氣泡 ③可發生縮聚反應,M的所有同分異構體在下列表征儀器中顯示的信號(或數據)完全相同是_____。
、環上有三個取代基②與NaHCO3反應產生氣泡 ③可發生縮聚反應,M的所有同分異構體在下列表征儀器中顯示的信號(或數據)完全相同是_____。
a.質譜儀 b.紅外光譜儀 c.元素分析儀 d.核磁共振儀
(5)利用題中信息和所學知識,寫出以A和甲烷為原料,合成![]() 的路線流程圖____________(其它試劑自選)。
的路線流程圖____________(其它試劑自選)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】β—紫羅蘭酮是存在于玫瑰花、番茄等中的一種天然香料,它經多步反應可合成維生素A1。下列說法正確的是( )
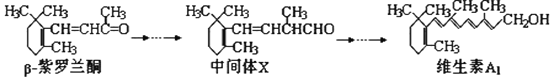
A. β—紫羅蘭酮與中間體X互為同分異構體
B. β—紫羅蘭酮不可使酸性KMnO4溶液褪色
C. 維生素A1易溶于NaOH溶液
D. 1mol維生素A1最多能與5molH2發生加成反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在1.0 L恒容密閉容器中放入0.10 mol X,在一定溫度下發生反應:X(g)![]() Y(g)+Z(g) ΔH<0,容器內氣體總壓強p隨反應時間t的變化關系如圖所示。以下分析正確的是 ( )
Y(g)+Z(g) ΔH<0,容器內氣體總壓強p隨反應時間t的變化關系如圖所示。以下分析正確的是 ( )
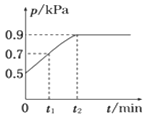
A. 該溫度下此反應的平衡常數K=3.2
B. 從反應開始到t1時的平均反應速率v(X)=0.2/t1 mol·L-1·min-1
C. 欲提高平衡體系中Y的百分含量,可加入一定量的X
D. 其他條件不變,再充入0.1 mol氣體X,平衡正向移動,X的轉化率減少
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室制備溴苯的反應裝置如下圖所示,關于實驗操作或敘述錯誤的是

A. 向圓底燒瓶中滴加苯和溴的混合液前需先打開K
B. 實驗中裝置b中的液體逐漸變為淺紅色
C. 裝置c中的碳酸鈉溶液的作用是吸收溴化氫
D. 反應后的混合液經稀堿溶液洗滌、結晶,得到溴苯
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com