
科目:高中化學 來源:不詳 題型:單選題

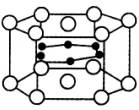

| A.MgB | B.MgB2 | C.Mg2B | D.Mg3B2 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.赤鐵礦的主要成分是Fe2O3 |
| B.鋁土礦的主要成分是Al2O3 |
| C.工業制備氯氣主要采用電解飽和食鹽水的方法 |
| D.把鐵礦石冶煉成鐵的過程中,還原劑主要是焦炭 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:問答題
查看答案和解析>>
科目:高中化學 來源:不詳 題型:問答題
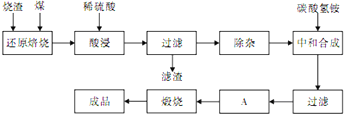
| 氫氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 開始沉淀的pH | 3.10 | 2.01 | 7.11 |
| 萬全沉淀的pH | 4.77 | 3.68 | 9.61 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題

| 溫度/0C | 15 | 20 | 25 | 30 | 35 | 40 | 45 |
| NaClO濃度/mol·L-1 | 4.6 | 5.2 | 5.4 | 5.5 | 4.5 | 3.5 | 2 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.若無固體剩余,則溶液中一定有Fe3+ |
| B.若有固體存在,則溶液中一定有Fe2+ |
| C.若溶液中有Cu2+,則一定沒有固體析出 |
| D.若溶液中有Fe2+,則一定有Cu析出 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:問答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com