
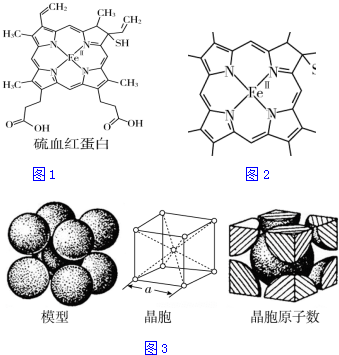
分析 (1)同一周期,自左而右電負性增大,同一主族,自上而下電負性減小;同主族,自上而下,元素的第一電離能減小,同一周期,自左而右元素的第一電離能增大,注意同一周期的第ⅡA元素的第一電離能大于第ⅢA族的,第ⅤA族的大于第ⅥA族的;
(2)具有相同原子數和最外層電子數的分子或離子叫等電子體,等電子體的結構和性質相似;分子間可以形成氫鍵使物質的粘度增大;
(3)根據C原子形成的σ鍵數目判斷雜化類型;N原子最外層有5個電子,只需要形成3條鍵即可達到穩定結構,但是圖中形成雙鍵的N原子形成了四條鍵,顯然有一條為配位鍵;(4)體心立方結構的配位數為8;利用均攤法計算晶胞的結構.
解答 解:(1)硫血紅蛋白中所含非金屬元素有:C、H、N、O、S,同周期元素從左到右元素的電負性逐漸增大,則有電負性C<N<O,H的電負性最小,所以電負性最大的是O;第一電離能最大的元素的原子是N;
故答案為:O;N;
(2)氧、硫屬于同主族,CS2和CO2是等電子體,CO2具有直線型結構的分子,正、負電荷中心重合,是為非極性分子,等電子體的結構相似,CS2是非極性分子;硫酸分子中含有羥基,形成氫鍵,濃硫酸粘度較大的原因是分子間可以形成氫鍵;
故答案為:非極性;硫酸分子間可以形成氫鍵;
(3)甲基中C原子形成4個σ鍵,采取sp3雜化,形成雙鍵的C原子形成3個σ鍵,采取sp2雜化;
N原子最外層有5個電子,只需要形成3條鍵即可達到穩定結構,但是圖中形成雙鍵的N原子形成了四條鍵,顯然有一條為配位鍵,用“→”標出N和Fe2+形成的配位鍵為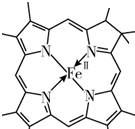 ;
;
故答案為:sp2、sp3; ;
;
(4)鐵的金屬密堆積方式為體心立方結構,晶胞中鐵原子的配位數為8;體心立方中含有1+8×$\frac{1}{8}$=2個鐵原子,晶胞中鐵原子的體積為:2×$\frac{4}{3}$×π×r3,體心立方中,體對角線上為三個鐵原子相切,則體對角線為4r,晶胞邊長為:$\frac{4r}{\sqrt{3}}$,晶胞體積為:($\frac{4r}{\sqrt{3}}$)3,空間利用率為:$\frac{2×\frac{4}{3}×π×{r}^{3}}{(\frac{4r}{\sqrt{3}})^{3}}$=$\frac{\sqrt{3}π}{8}$,
故答案為:8;$\frac{\sqrt{3}π}{8}$.
點評 本題考查物質結構與性質,涉及元素性質遞變規律、等電子原理應用、分子性質、配位鍵、晶胞計算等,(4)中計算為易錯點、難點,需要學生具備一定的數學計算能力,題目難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:計算題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na、Mg、Al元素最高化合價依次升高 | |
| B. | P、Cl最高價氧化物對應的水化物酸性增強 | |
| C. | N、O、F元素非金屬性依次減弱 | |
| D. | Li、Na、K原子的電子層數依次增多 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
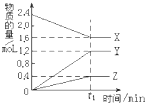 I.某溫度下,在2L容器中3種物質間進行反應,X、Y、Z的物質的量隨時間的變化曲線如圖.反應在t1min時到達平衡,依圖所示:
I.某溫度下,在2L容器中3種物質間進行反應,X、Y、Z的物質的量隨時間的變化曲線如圖.反應在t1min時到達平衡,依圖所示: 3Y+Z.
3Y+Z.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 某校課外實驗小組同學設計如圖裝置進行實驗.(夾持裝置已略去).
某校課外實驗小組同學設計如圖裝置進行實驗.(夾持裝置已略去).| 飽和醇的質量 | 金屬鈉的質量 | 量氣管第一次讀數 | 量氣管第二次讀數 | |
| ① | 0.62g | 5.0g(足量) | 40mL | 264mL |
| ② | 0.31g | 2.5g(足量) | 40mL | 152mL |
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 維生素A的分子式為C20H32O | |
| B. | 維生素A可被催化氧化為醛 | |
| C. | 維生素A是一種易溶于水的醇 | |
| D. | 1mol維生素A在催化劑作用下最多可與7mol H2發生加成反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 元素代號 | L | M | Q | R | T |
| 原子半徑/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合價 | +2 | +3 | +2 | +6、-2 | -2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 銅基態原子核外電子排布式為1s22s22p63s23p64s13d10 | |
| B. | 在d軌道中電子排布成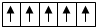 而不是 而不是 ,其最直接的根據是泡利原理 ,其最直接的根據是泡利原理 | |
| C. | 下列軌道的能量是按由高到低排列的E5s>E4s>E3d>E2p>E1s | |
| D. | 焰色反應、激光、霓虹燈光等與原子核外電子發生躍遷釋放能量有關 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com