
物質 T/℃n/mol T/℃ | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | ||
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
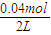 =0.02mol/L,c(N2)=c(CO2)=
=0.02mol/L,c(N2)=c(CO2)=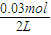 =0.015mol/L,故T1℃時該反應的平衡常數為K1=
=0.015mol/L,故T1℃時該反應的平衡常數為K1=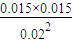 =
=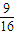 ,故答案為:
,故答案為: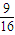 ;
; 4CO2↑+CO↑+6Fe,
4CO2↑+CO↑+6Fe, 4CO2↑+CO↑+6Fe.
4CO2↑+CO↑+6Fe.

科目:高中化學 來源: 題型:
| 活性炭 (mol) |
NO (mol) |
A (mol) |
B (mol) | |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| 平衡 | 2.000 | 0.040 | 0.030 | 0.030 |
| c(N2)?c(CO2) |
| c2(CO) |
| c(N2)?c(CO2) |
| c2(CO) |
查看答案和解析>>
科目:高中化學 來源: 題型:
物質 T/℃n/mol T/℃ |
活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
| 9 |
| 16 |
| 9 |
| 16 |
| ||
| ||
查看答案和解析>>
科目:高中化學 來源:2012-2013學年上海市浦東新區高三下學期二模化學試卷(解析版) 題型:填空題
碳單質在工業上有多種用途。例如焦炭可用來制取水煤氣、冶煉金屬,活性炭可處理大氣污染物NO。
一定條件下,在2 L密閉容器中加入NO和活性炭(無雜質)反應生成氣體A和B。當溫度在T1℃時,測得各物質平衡時物質的量如下表:
|
|
活性炭 (mol) |
NO (mol) |
A (mol) |
B (mol) |
|
初始 |
2.030 |
0.100 |
0 |
0 |
|
平衡 |
2.000 |
0.040 |
0.030 |
0.030 |
(1)在T1℃時,達到平衡共耗時2分鐘,則NO的平均反應速率為 mol/(L·min);當活性炭消耗0.015mol時,反應的時間 (填“大于”、“小于”或“等于”)1分鐘。
(2)在T1℃下反應達到平衡后,下列措施不能改變NO的轉化率的是 。
a.增大活性炭的量 b.增大壓強 c.升高溫度 d.移去部分B
(3)結合上表數據,該反應的平衡常數表達式為 。(生成物A、B用相應的化學式表示)若T1℃時的平衡常數為K1,T2℃時的平衡常數為K2,且K1>K2,能否判斷該反應是吸熱反應還是放熱反應,說明理 。
查看答案和解析>>
科目:高中化學 來源:2012-2013學年上海市浦東新區高三4月高考預測(二模)化學試卷(解析版) 題型:填空題
碳單質在工業上有多種用途。例如焦炭可用來制取水煤氣、冶煉金屬,活性炭可處理大氣污染物NO。一定條件下,在2 L密閉容器中加入NO和活性炭(無雜質)反應生成氣體A和B。當溫度在T1℃時,測得各物質平衡時物質的量如下表:
|
|
活性炭 (mol) |
NO (mol) |
A (mol) |
B (mol) |
|
初始 |
2.030 |
0.100 |
0 |
0 |
|
平衡 |
2.000 |
0.040 |
0.030 |
0.030 |
在T1℃時,達到平衡共耗時2分鐘,則NO的平均反應速率為 mol/(L·min);當活性炭消耗0.015mol時,反應的時間 (填“大于”、“小于”或“等于”)1分鐘。
在T1℃下反應達到平衡后,下列措施不能改變NO的轉化率的是 。
a.增大活性炭的量 b.增大壓強 c.升高溫度 d.移去部分B
結合上表數據,該反應的平衡常數表達式為 。(生成物A、B用相應的化學式表示)若T1℃時的平衡常數為K1,T2℃時的平衡常數為K2,且K1>K2,能否判斷該反應是吸熱反應還是放熱反應,說明理 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com