
分析 (1)(2)化合物甲(LiXH2)加熱至完全分解,可生成固體化合物A,并釋放出2.24L氣體B,B可使濕潤的紅色石蕊試紙變藍,則B為NH3,由元素守恒可知,X為N元素,甲為LiNH2,4.60g甲的物質的量為$\frac{4.60g}{23g/mol}$=0.2mol,氨氣物質的量為$\frac{2.24L}{22.4L/mol}$=0.1mol,根據原子守恒可知A中Li、N、H原子數目之比為0.2mol:(0.2mol-0.1mol):(0.4mol-0.3mol)=2:1:1,故A的化學式為Li2NH;
(3)LiH與水反應生成LiOH與氫氣;
(4)丙是由X(氮)和Li組成的二元化合物,其陰離子的電子數和二氧化碳相同,則丙為LiN3,丙分解可生成另一種形式的二元化合物和一種無色無味的單質氣體,分解生成Li3N、N2;
(5)LiH中氫元素為-1價,NH3氫元素為+1價,根據氧化還原歸中原理,能發生反應生成甲.
解答 解:(1)化合物甲(LiXH2)加熱至完全分解,可生成固體化合物A,并釋放出2.24L氣體B,B可使濕潤的紅色石蕊試紙變藍,則B為NH3,由元素守恒可知,X為N元素,甲為LiNH2,故答案為:LiNH2;
(2)4.60g甲的物質的量為$\frac{4.60g}{23g/mol}$=0.2mol,氨氣物質的量為$\frac{2.24L}{22.4L/mol}$=0.1mol,根據原子守恒可知A中Li、N、H原子數目之比為0.2mol:(0.2mol-0.1mol):(0.4mol-0.3mol)=2:1:1,故A的化學式為Li2NH,甲加熱分解生成A和B的化學方程式:2 LiNH2$\frac{\underline{\;加熱\;}}{\;}$Li2NH+NH3↑,
故答案為:2 LiNH2$\frac{\underline{\;加熱\;}}{\;}$Li2NH+NH3↑;
(3)LiH與水反應生成LiOH與氫氣,反應方程式為:LiH+H2O=LiOH+H2↑,
故答案為:LiH+H2O=LiOH+H2↑;
(4)丙是由X(氮)和Li組成的二元化合物,其陰離子的電子數和二氧化碳相同,則丙為LiN3,丙分解可生成另一種形式的二元化合物和一種無色無味的單質氣體,分解生成Li3N、N2,丙發生分解反應的化學方程式:3LiN3=Li3N+4N2↑,
故答案為:3LiN3=Li3N+4N2↑;
(5)LiH中氫元素為-1價,NH3氫元素為+1價,根據氧化還原歸中原理,能發生反應生成甲,該同學說法合理,
故答案為:該同學說法合理.LiH中氫元素為-1價,NH3氫元素為+1價,根據氧化還原歸中原理,能發生反應生成甲.
點評 本題考查無機物推斷,題目素材不是中學內容,側重考查學生分析推理與計算能力,較好的考查學生對知識遷移應用,難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | HCl的電子式: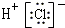 | B. | ${\;}_{8}^{18}$O2-離子的原子結構示意圖: | ||
| C. | CO2分子的結構式:O=C=O | D. | 四氯化碳分子比例模型: |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 液溴易揮發,實驗室常用水液封并密封保存 | |
| B. | 金屬鈉遇到氧氣立即反應,常保存在煤油中 | |
| C. | 濃硫酸有強腐蝕性,常溫時不可用鐵質容器貯運 | |
| D. | 硅酸鈉溶液應用帶橡膠塞的細口瓶保存 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
 中國藥學家屠呦呦因青蒿素而獲得2015年諾貝爾生理學或醫學獎.青蒿素的結構如圖所示,下列說法不正確的是( )
中國藥學家屠呦呦因青蒿素而獲得2015年諾貝爾生理學或醫學獎.青蒿素的結構如圖所示,下列說法不正確的是( )| A. | 該物質易溶于冷水 | B. | 能夠發生水解反應 | ||
| C. | 每個分子中含有3個六元環 | D. | 青蒿素具有強氧化性 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | x=2 | |
| B. | 參加反應的Fe2+全部作還原劑 | |
| C. | 每生成1molFe3O4,反應轉移電子的總物質的量為4mol電子 | |
| D. | 1molFe2+被氧化時,被Fe2+還原的O2的物質的量為$\frac{1}{3}$mol |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鎂和鐵 | B. | 鈉和鐵 | C. | 鈉和鋁 | D. | 鐵和銅 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Mg2+、SO42-、K+、Cl- | B. | Na+、NH4+、NO3-、Fe3+ | ||
| C. | K+、CO32-、Cl-、Br- | D. | Ba2+、Na+、OH-、SO42- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com