
科目:高中化學 來源: 題型:閱讀理解
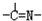 三種基團,無環狀結構,三種基團的數目關系為n3=
三種基團,無環狀結構,三種基團的數目關系為n3=

查看答案和解析>>
科目:高中化學 來源:2012-2013學年上海市閘北區高三下學期二模化學試卷(解析版) 題型:計算題
含有硫的化合物在工業生產中應用廣泛,回答下列問題:
(1)黃銅礦是工業煉銅的主要原料,其主要成分為CuFeS2。
①測得某黃銅礦(CuFeS2)中含硫20%(質量分數),求該礦石含銅的質量分數。
②現有一種天然黃銅礦(含少量脈石),為了測定該黃銅礦的純度,某同學設計了如下實驗:稱取
研細的黃銅礦樣品1.150g,在空氣中進行煅燒,生成Cu、Fe3O4和SO2氣體,用100 mL滴有淀粉的
蒸餾水全部吸收SO2,然后取10mL吸收液,用0.05mol/L標準碘溶液進行滴定,用去標準碘溶液的體
積為20.00mL。求該黃銅礦的純度。
(2)將FeS和Fe2O3的混和物56.6 g,用足量稀H2SO4溶解后可得3.2 g硫,原混和物中FeS的質量。
(3)一定溫度下,硫酸銅受熱分解生成CuO、SO2、SO3和O2。已知:SO2、SO3都能被堿石灰和氫氧
化鈉溶液吸收。利用下圖裝置加熱無水硫酸銅粉末直至完全分解。若無水硫酸銅粉末質量為10.0 g,
完全分解后,各裝置的質量變化關系如下表所示。
|
裝置 |
A(試管+粉末) |
B |
C |
|
反應前 |
42.0 g |
75.0 g |
140.0 g |
|
反應后 |
37.0 g |
79.0 g |
140.5 g |

請通過計算,推斷出該實驗條件下硫酸銅分解的化學方程式。
(4)硫化鈉是用于皮革的重要化學試劑,可用無水Na2SO4與炭粉在高溫下反應制得,化學方程式如下:
①Na2SO4
+ 4C Na2S + 4CO↑ ②Na2SO4
+ 4CO
Na2S + 4CO↑ ②Na2SO4
+ 4CO Na2S + 4CO2
Na2S + 4CO2
a.若在反應過程中,產生CO和CO2混合氣體為2mol,求生成Na2S的物質的量。
b.硫化鈉晶體放置在空氣中,會緩慢氧化成Na2SO3,甚至是Na2SO4,現將43.72g部分變質的硫化鈉樣品溶于水中,加入足量鹽酸后,過濾得4.8g沉淀和1.12L H2S 氣體(標準狀況,假設溶液中氣體全部逸出),在濾液中加入足量的BaCl2后過濾得2.33g沉淀,分析該硫化鈉樣品的成分及其物質的量。
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
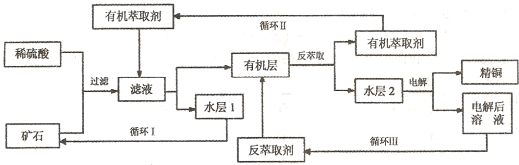
現代社會中銅在電氣、交通、機械和冶金、能源及石化工業、高科技等領域有廣泛的應用。某銅礦石含氧化銅、氧化亞銅、三氧化二鐵和脈石(Si02) ,現采用酸浸法從礦石中提取銅,其工藝流程圖如下。其中銅的萃取(銅從水層進人有機層的過程)和反萃取(銅從有機層進人水層的過程)是現代濕法煉銅的重要工藝手段。

已知:①Cu2O+2H+=Cu2++Cu + H2O;②當礦石中三氧化二鐵含量太低時,可用硫酸和硫酸鐵的混合液浸出銅;③反萃取后的水層2是硫酸銅溶液。回答下列問題:
(1)礦石用稀硫酸處理過程中發生反應的離子方程式為:Cu2O+2H+=Cu2++Cu + H2O、
、 。(寫出其中2個)
(2)“循環I”經多次循環后的水層1不能繼續循環使用,但可分離出一種重要的硫酸鹽晶體.若水層1暴露在空氣中一段時間后,可以得到另一種重要的硫酸鹽,寫出水層l暴露在空氣中發生反應的離子方程式 。
(3)“循環n”中萃取劑是一類稱作為肟類的有機化合物,如N-510、N-530等。某肟類化合物A的分子結構中僅含n1個-CH3、n2個-OH和n3個![]() 三種基團,無環狀結構,三種基團的數目關系為n3= 。若A的相對分子質量為116,上述基團連接時碳原子跟碳原子相連,則A的結構簡式是 。
三種基團,無環狀結構,三種基團的數目關系為n3= 。若A的相對分子質量為116,上述基團連接時碳原子跟碳原子相連,則A的結構簡式是 。
(4)寫出電解過程中陽極(惰性電極)發生反應的電極反應式 。
(5)該工藝最大亮點是它符合下列原理 (填字母,下同)。
A.化學平衡 B.綠色化學 C.質量守恒 D.能量守恒
E.相似相溶 F.酸堿中和 G.氧化還原反應
(6)銅、銀、金是人類認識最早的三種金屬,因為很早就被人們用作錢幣,因而有“貨幣金屬”之稱。由于鐵的金屬性比銅、銀、金強,相對而言,人類認識鐵稍晚。某研究性學習小組為了證明鐵的金屬活動性比銅強,他設計了如下方案:①鐵片置于硫酸銅溶液中有銅析出;②鐵、銅和氯氣反應分別生成FeCl3和CuCl2;③足量的鐵粉和銅粉和濃硫酸反應生成FeSO4和CuSO4;④銅片置于FeCl3溶液中銅片逐漸溶解;⑤把鐵片和銅片置于盛有稀硫酸的燒杯中,交用導線連接,鐵片上無氣泡產生,而銅片上有氣泡產生;⑥把鐵片和銅片置于盛有濃硝酸的燒杯中,并用導線連接,鐵片上有氣泡產生,而銅片上無氣泡產生。以上設計合理的有 。
A.兩種方案 B.三種方案 C.四種方案 D.五種方案
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com