
已知:C(s,石墨) == C(s,金剛石) ΔH = +1.9 kJ·mol-1。下列有關說法正確的是
A.相同條件下,1 mol石墨比1 mol金剛石能量高
B.斷裂1mol石墨中的化學鍵吸收的能量比斷裂1mol金剛石中的化學鍵吸收的能量少
C.若:C(s,石墨) + O2(g)== CO2(g) ΔH1=-393.5 kJ•mol-1
則有:C(s,金剛石) + O2(g)== CO2(g) ΔH2=-395.4 kJ·mol-1
D.其他條件不變時,加入合適的催化劑,可實現該反應的反應熱轉變為ΔH<0
C
【解析】
試題分析:A、從題設條件中的化學方程式可以看出,在相同的條件下,1mol石墨轉化為金剛石,要吸收1.9kJ的能量,說明石墨的能量低于金剛石的能量,石墨更穩定.金剛石的能量高,錯誤;B、石墨的鍵能比金剛石的鍵能高,因此,斷裂1mol石墨中的化學鍵吸收的能量比斷裂1mol金剛石中的化學鍵吸收的能量要多,錯誤;C、從題意來看,1mol C(s,金剛石)自身具有的能量比1mol C(s,石墨)自身具有的能量要高1.9 kJ·mol-1,燃燒時,1mol C(s,金剛石)放出的熱量要比1mol C(s,石墨)要多1.9 kJ,正確;D、對于一個確定的化學反應,化學反應的焓變(ΔH)是確定的,不隨著外界條件的改變而改變,錯誤。
考點:考查化學反應中的能量變化、焓變的含義。


科目:高中化學 來源: 題型:
(6分)為了合理利用化學能,確保安全生產,化工設計需要充分考慮化學反應的焓變,并采取相應措施。化學反應的焓變通常用實驗進行測定,也可進行理論推算。
(1)實驗測得,5g液態甲醇(CH3OH)在氧氣中充分燃燒生成二氧化碳氣體和液態水時釋放出113.5kJ的熱量,試寫出甲醇燃燒的熱化學方程式_________________。
(2)由氣態基態原子形成1mol化學鍵釋放的最低能量叫鍵能。從化學鍵的角度分析,化學反應的過程就是反應物的化學鍵的破壞和生成物的化學鍵的形成過程。在化學反應過程中,拆開化學鍵需要消耗能量,形成化學鍵又會釋放能量。
| 化學鍵 | H-H | N-H | N≡N |
| 鍵能/kJ·mol-1 | 436 | 391 | 945 |
已知反應N2+3H22NH3 △H=a kJ·mol-1。試根據表中所列鍵能數據估算a的數值為________。
(3)依據蓋斯定律可以對某些難以通過實驗直接測定的化學反應的焓變進行推算。
已知:C(s,石墨)+02(g)=C02(g) △H1=-akJ·mol-1
2H2(g)+02(g)=2H20(l) △H2=-bkJ·mol-1
2C2H2(g)+502(g)=4C02(g)+2H20(l) △H3=-ckJ·mol-1
根據蓋斯定律,計算298K時由C(s,石墨)和H2(g)生成1mol C2H2(g)反應的焓變 :△H=_________。
查看答案和解析>>
科目:高中化學 來源:2012-2013年海南瓊海嘉積中學高二上高中教學質量監測理化學試卷(帶解析) 題型:單選題
下列說法正確的是( )
| A.任何酸與堿發生中和反應生成1 mol H2O的過程中,能量變化均相同 |
| B.同溫同壓下,H2(g)+Cl2(g)===2HCl(g)在光照和點燃條件下的ΔH相同 |
| C.已知:①2H2(g)+O2(g)===2H2O(g)ΔH1=-a kJ·mol-1, ②2H2(g)+O2(g)===2H2O(l)ΔH2=-b kJ·mol-1,則a>b |
| D.已知:①C(s,石墨)+O2(g)===CO2(g)ΔH1=-393.5 kJ·mol-1, |
查看答案和解析>>
科目:高中化學 來源:2011-2012學年浙江省永嘉縣普高聯合體高二第二學期第一次月考化學試卷 題型:填空題
(6分)為了合理利用化學能,確保安全生產,化工設計需要充分考慮化學反應的焓變,并采取相應措施。化學反應的焓變通常用實驗進行測定,也可進行理論推算。
(1)實驗測得,5g液態甲醇(CH3OH)在氧氣中充分燃燒生成二氧化碳氣體和液態水時釋放出113.5kJ的熱量,試寫出甲醇燃燒的熱化學方程式_________________。
(2)由氣態基態原子形成1mol化學鍵釋放的最低能量叫鍵能。從化學鍵的角度分析,化學反應的過程就是反應物的化學鍵的破壞和生成物的化學鍵的形成過程。在化學反應過程中,拆開化學鍵需要消耗能量,形成化學鍵又會釋放能量。
| 化學鍵 | H-H | N-H | N≡N |
| 鍵能/kJ·mol-1 | 436 | 391 | 945 |
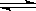 2NH3 △H="a" kJ·mol-1。試根據表中所列鍵能數據估算a的數值為________。
2NH3 △H="a" kJ·mol-1。試根據表中所列鍵能數據估算a的數值為________。查看答案和解析>>
科目:高中化學 來源:2015屆江蘇省常州市高二化學期末模測化學試卷一(解析版) 題型:填空題
(1)8g液態的CH3OH在氧氣中完全燃燒,生成二氧化碳氣體和液態水時釋放出Q kJ的熱量。試寫出液態CH3OH燃燒熱的熱化學方程式 。
(2)在化學反應過程中,破壞舊化學鍵需要吸收能量,形成新化學鍵又會釋放能量。
|
化學鍵 |
H—H |
N—H |
N≡N |
|
鍵能/kJ·mol-1 |
436 |
391 |
945 |
已知反應N2+3H2=2NH3 ΔH=a KJ/mol。
試根據表中所列鍵能數據計算a的數值為: 。
(3)已知:C(s,石墨)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ/mol
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2599 kJ/mol
根據蓋斯定律,由C(s,石墨)和H2(g)生成1 mol C2H2(g)反應的熱化學方程式: 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com