


 陽光考場單元測試卷系列答案
陽光考場單元測試卷系列答案 名校聯盟沖刺卷系列答案
名校聯盟沖刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 課程達標測試卷闖關100分系列答案
課程達標測試卷闖關100分系列答案科目:高中化學 來源: 題型:
| 組別 | 藥品1 | 藥品2 | 實驗現象 |
| Ⅰ | 0.1mol/LNaOH溶液 | 0.1mol/LMgCl2溶液 | 生成白色沉淀 |
| Ⅱ | 0.1mol/L氨水 | 0.1mol/LMgCl2溶液 | 無現象 |
| Ⅲ | 1mol/L氨水 | 1mol/LMgCl2溶液 | 現象Ⅲ |
| Ⅳ | 1mol/L氨水 | 0.1mol/LMgCl2溶液 | 生成白色沉淀 |
| Ⅴ | 0.1mol/L氨水 | 1mol/LMgCl2溶液 | 無現象 |
| A、實驗Ⅱ、Ⅴ無現象,而Ⅳ生成白色沉淀,說明增大c(Mg2+)不能向生成沉淀的方向移動,增大氨水溶液的濃度才能向生成沉淀的方向移動 |
| B、實驗Ⅲ無現象,因為氯化鎂溶液和氨水濃度都增大,則導致氯化銨濃度增大,而氫氧化鎂可以溶解在氯化銨溶液中 |
| C、由于氫氧化鎂可以溶解在氯化銨溶液中,而氯化鎂溶液和氨水反應可以生成氯化銨,所以該兩種溶液混合后可能會出現先生成沉淀后溶解的現象 |
| D、實驗Ⅲ的現象是生成白色沉淀,因為增大兩種溶液中任意一種的濃度,都能使混合液的離子積達到氫氧化鎂的Ksp |
查看答案和解析>>
科目:高中化學 來源: 題型:
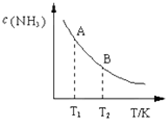 氮是地球上含量豐富的一種元素,氮及其化合物在工農業生產.生活中有著重要作用.請回答下列問題:
氮是地球上含量豐富的一種元素,氮及其化合物在工農業生產.生活中有著重要作用.請回答下列問題:| 一定條件 |
| 時間/min 濃度/mol?L-1 | c (N2) | c (H2) | c (NH3) |
| 0 | 0.6 | 1.8 | 0 |
| 3 | 0.52 | x | 0.16 |
| 6 | 0.36 | 1.08 | 0.48 |
| 9 | 0.36 | 1.08 | 0.48 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、AgCl沉淀生成和溶解不斷進行,但速率相等 |
| B、AgCl難溶于水,其溶液中沒有Ag+和Clˉ |
| C、升高溫度,AgCl沉淀的溶解度不變 |
| D、向AgCl沉淀中加入NaCl固體,AgCl沉淀的溶解度不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化學 來源: 題型:
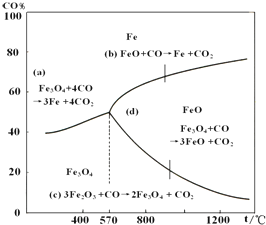 鋼鐵工業在我國國民經濟中處于十分重要的位置,工業上采用高爐煉鐵,常用赤鐵礦、焦炭、空氣與熔劑(石灰石)作原料.已知赤鐵礦被還原劑還原是逐級進行的,還原時溫度及CO、CO2平衡混合氣中CO的體積分數的關系如圖:
鋼鐵工業在我國國民經濟中處于十分重要的位置,工業上采用高爐煉鐵,常用赤鐵礦、焦炭、空氣與熔劑(石灰石)作原料.已知赤鐵礦被還原劑還原是逐級進行的,還原時溫度及CO、CO2平衡混合氣中CO的體積分數的關系如圖:查看答案和解析>>
科目:高中化學 來源: 題型:
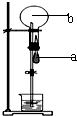 a表示膠頭滴管中的液體,b表示燒瓶中的氣體.不能形成噴泉實驗現象的a中液體和b中氣體的組合是( )
a表示膠頭滴管中的液體,b表示燒瓶中的氣體.不能形成噴泉實驗現象的a中液體和b中氣體的組合是( )| A、a-NaOH溶液、b-HCl氣體 |
| B、a-NaOH溶液、b-CO2氣體 |
| C、a-HCl溶液、b-NH3氣體 |
| D、a-水、b-CO2氣體 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 序號 | 實驗方案 | 實驗現象 |
| ① | 向盛有少量溴化鈉溶液的試管中滴加少量新制氯水,振蕩,再加入少量四氯化碳,振蕩后靜置 | 液體分為兩層,下層呈 |
| ② | 向盛有少量碘化鈉溶液的試管中滴加少量新制溴水,振蕩,再加入少量四氯化碳,振蕩后靜置 | 液體分為兩層,下層呈 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com