
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
| 開始沉淀 | 1.1 | 4.0 | 5.4 |
| 完全沉淀 | 3.2 | 5.2 | 6.7 |
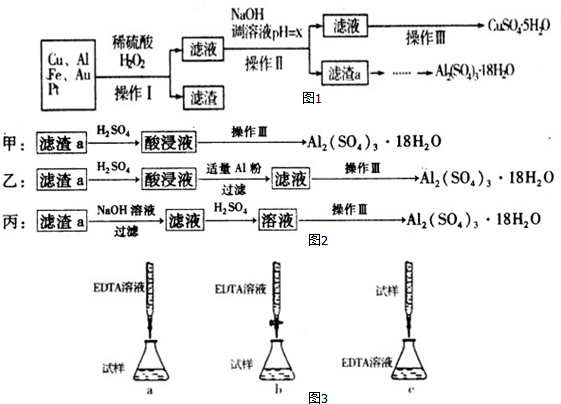
分析 由流程可知,金屬混合物加入稀硫酸后鋁、鐵溶解,加入過氧化氫,亞鐵離子被氧化為鐵離子,銅在酸性溶液中被過氧化氫氧化為銅離子,過濾得到濾渣為Au、Pt,濾液中主要含有鐵離子、鋁離子和銅離子,加入氫氧化鈉溶液調節溶液PH=5.2-5.4使鋁離子全部沉淀,同時鐵離子也轉化為沉淀,過濾得到濾渣a為Al(OH)3和Fe(OH)3,用硫酸溶解后加Al調節pH,把鐵離子轉化為沉淀,過濾,濾液為硫酸鋁溶液,蒸發、濃縮、冷卻、結晶、過濾得到Al2(SO4)2•18H2O晶體;含有硫酸銅的濾液,通過蒸發濃縮,冷卻結晶,過濾洗滌得到硫酸銅晶體;
(1)操作Ⅰ后,過濾得到濾渣為Au、Pt;
(2)酸性條件下銅被雙氧水氧化成銅離子;
(3)調節pH使鐵離子和鋁離子完全沉淀,銅離子不沉淀,根據表中數據判斷;
(4)濾渣a是氫氧化鋁和氫氧化鐵,用硫酸溶解,調節pH除去鐵離子;
(5)①根據反應方程式及滴定數據計算出硫酸銅的物質的量,再計算出硫酸銅晶體的質量分數;
②EDTA(Na2H2Y)標準溶液滴定其中的Cu2+,則EDTA盛放在酸式滴定管中.
解答 解:(1)操作Ⅰ后,過濾得到濾渣為Au、Pt,
故答案為:Au、Pt;
(2)酸性條件下銅被雙氧水氧化成銅離子,則Cu與雙氧水、硫酸反應生成硫酸銅和水,則反應的離子方程式為:Cu+H2O2+2H+=Cu2++2H2O,
故答案為:Cu+H2O2+2H+=Cu2++2H2O;
(3)調節pH使鐵離子和鋁離子完全沉淀,銅離子不沉淀,根據表中數據可知pH=5.2是鋁離子完全沉淀,pH=5.4時銅離子開始沉淀,所以調節pH為5.2≤x<5.4,
故答案為:5.2≤x<5.4;
(4)濾渣a是氫氧化鋁和氫氧化鐵,用硫酸溶解,得到硫酸鋁和硫酸鐵,加入Al調節pH使鐵離子轉化為氫氧化鐵沉淀,過濾除去沉淀,則剩余的濾液為硫酸鋁沉淀,然后蒸發濃縮得到硫酸鋁晶體;所以乙方案符合;
故答案為:乙;
(5)①根據方程式可知20.00mL溶液中n(CuSO4•5H2O)=n(EDTA)=b×12×10-3mol;
所以m(CuSO4•5H2O)=b×12×10-3mol×250g/mol=3bg,
因此100mL溶液中CuSO4•5H2O的質量為:3b×5=15bg,所以ω=$\frac{15b}{a}$×100%,
故答案為:$\frac{15b}{a}$×100%;
②EDTA(Na2H2Y)標準溶液滴定其中的Cu2+,則EDTA盛放在滴定管中,該溶液顯酸性,用酸式滴定管,所以最合理的為b;
故答案為:b.
點評 本題考查了物質的制備實驗方案設計,題目涉及方程式的書寫、除雜質、實驗基本操作、物質含量的測定等,題目考查的知識點較多,側重于基礎知識的綜合應用的考查,題目難度中等.


科目:高中化學 來源:2016-2017學年陜西省高二上月考一化學卷(解析版)) 題型:選擇題
某溫度下,反應SO2(g)+1/2O2(g)  SO3(g)的平衡常數K1=20,在同一溫度下,反應2SO3(g)
SO3(g)的平衡常數K1=20,在同一溫度下,反應2SO3(g)  2SO2(g) + O2(g)的平衡常數K2的值為
2SO2(g) + O2(g)的平衡常數K2的值為
A.400 B.500 C.4×10-4 D.2.5×10-3
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 銅、鎵、硒、硅等元素的化合物是生產第三代太陽能電池的重要材料.請回答:
銅、鎵、硒、硅等元素的化合物是生產第三代太陽能電池的重要材料.請回答:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
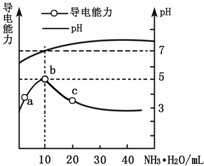 常溫下,向10mL 0.1mol•L-1的HR溶液中逐滴滴入0.1mol•L-1的氨水,所得溶液pH及導電性變化如圖.下列分析不正確的是( )
常溫下,向10mL 0.1mol•L-1的HR溶液中逐滴滴入0.1mol•L-1的氨水,所得溶液pH及導電性變化如圖.下列分析不正確的是( )| A. | b點溶液pH=5,此時酸堿恰好中和 | |
| B. | a~b點導電能力增強,說明HR為弱酸 | |
| C. | c點溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+) | |
| D. | b~c任意點溶液均有c(H+)•c(OH-)=KW=1.0×10-14 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 與銅質水龍頭連接處的鋼質水管不易發生腐蝕 | |
| B. | 一種金屬元素可能有多種氧化物,同一金屬同一價態也可能有多種氧化物 | |
| C. | 金屬鈉、鎂等金屬著火時,可以使用泡沫滅火器來滅火 | |
| D. | 工業上可用鋁熱反應大規模煉鐵 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題

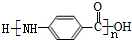 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氯化鈉的電子式為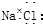 ? ? | |
| B. | 乙烯的結構簡式:CH2CH2 | |
| C. | 氯化氫分子的形成過程可用電子式表示為:H×+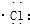 → →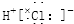 | |
| D. | 重水的化學式為${\;}_{1}^{2}$H2O(或D2O) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com