
【題目】工業上,以鈦鐵礦(主要含FeTiO3,還含有Fe2O3 和Al2O3、SiO2等雜質)為原料制備二氧化鈦并得到副產品綠礬(FeSO4·7H2O)的工藝流程如下圖所示。
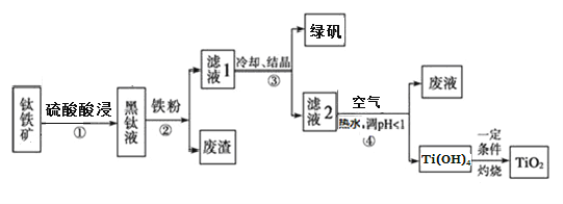
已知:TiO2+在一定條件下會發生水解。
回答下列問題:
(1)要提高酸浸時鈦礦石的溶解速率,可行的措施是(寫一條即可)_______________。黑鈦液中生成的主要陽離子有TiO2+和Fe2+,步驟①主要反應的化學方程式是_________。
(2)步驟②中,加入鐵粉的主要作用是_____,同時也會將部分TiO2+還原為Ti3+。
(3)向濾液2中通入空氣的目的是______(用離子方程式表示)。
(4)請結合化學用語用化學平衡理論解釋步驟④中加入熱水稀釋將TiO2+轉化為Ti(OH)4 的原因:_________________。
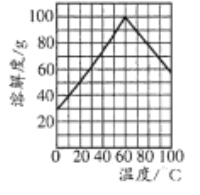
(5)副產品綠礬中含有雜質[Al2(SO4)3]。要將副產品進一步提純,請結合右圖的綠礬溶解度曲線完成提純過程:將副產品溶于稀硫酸中,充分攪拌后,用NaOH溶液調節反應液的pH約為5,過濾沉淀后得到FeSO4溶液,______,過濾,用冰水洗滌,低溫干燥,得到FeSO4·7H20晶體。
(6)用氧化還原滴定法測定制備得到的產品中TiO2的質量分數:在一定條件下,將一定量的產品溶解并將TiO2還原為Ti3+,再以KSCN溶液作為指示劑,用硫酸鐵銨[NH4Fe(SO4)2]標準溶液滴定Ti3+至全部生成Ti4+。
①滴定終點的現象是_______________。
②滴定分析時,稱取TiO2試樣0.2 g,消耗0.1 mol/L NH4Fe(SO4)2標準溶液24.00mL,則TiO2的質量分數為_______________。
【答案】粉碎礦石或加熱反應物或及時攪拌等 FeTiO3+2H2SO4![]() FeSO4+TiOSO4+2H2O 將Fe3+轉化為Fe2+并防止Fe2+被氧化 4Ti3++ O2 + 2H2O
FeSO4+TiOSO4+2H2O 將Fe3+轉化為Fe2+并防止Fe2+被氧化 4Ti3++ O2 + 2H2O![]() 4TiO2+ + 4H+ TiO2+在溶液中水解:TiO2+ + 3H2O
4TiO2+ + 4H+ TiO2+在溶液中水解:TiO2+ + 3H2O ![]() Ti(OH)4 + 2H+ △H>0,當加入熱水稀釋、升溫后,平衡正向移動,生成Ti(OH)4 加熱濃縮得到60℃的飽和溶液,再冷卻至室溫(或0℃)結晶 滴入最后滴標準溶液時, 錐形瓶內溶液變成紅色, 且半分鐘不褪色 96%
Ti(OH)4 + 2H+ △H>0,當加入熱水稀釋、升溫后,平衡正向移動,生成Ti(OH)4 加熱濃縮得到60℃的飽和溶液,再冷卻至室溫(或0℃)結晶 滴入最后滴標準溶液時, 錐形瓶內溶液變成紅色, 且半分鐘不褪色 96%
【解析】
(1)要提高酸浸時鈦礦石的溶解速率,可增大接觸面積、加熱或加快攪拌;黑鈦液中生成的主要陽離子有TiO2+和Fe2+,他們的存在形式是TiOSO4和FeSO4,反應的化學方程式是:FeTiO3+2H2SO4![]() FeSO4+TiOSO4+2H2O;
FeSO4+TiOSO4+2H2O;
(2)由(1)可知黑鈦液中生成的主要陽離子有TiO2+和Fe2+,加入鐵粉的目的除了可將部分TiO2+還原為Ti3+之外,還可將Fe3+轉化為Fe2+并防止Fe2+被氧化;
(3)向濾液2中通入空氣,可將三價的鈦離子氧化成TiO2+,用離子方程式表示為:4Ti3++ O2 + 2H2O=4TiO2+ + 4H+
(4)TiO2+在一定條件下會發生水解生成Ti(OH)4和氫離子,溶液中存在平衡:TiO2++3H2O![]() Ti(OH)4+2H+,△H>0,當加入熱水稀釋、升溫后,平衡正向移動,生成Ti(OH)4;
Ti(OH)4+2H+,△H>0,當加入熱水稀釋、升溫后,平衡正向移動,生成Ti(OH)4;
(5)根據金屬離子沉淀的pH值,通過滴加NaOH溶液調節pH至5.0把Al3+除去,過濾,即得到FeSO4溶液,加熱濃縮得到60℃飽和溶液,然后放在冰水中冷卻至室溫,冷卻結晶,后過濾,洗滌,低溫干燥,得到FeSO4·7H20晶體;
(6)①TiO2中Ti的化合價由+4價→+3價,化合價降低,把Fe2+氧化成Fe3+,Fe3+與KSCN溶液,溶液變紅,即滴定到終點的現象是:滴入最后一滴標準溶液時, 錐形瓶內溶液變成紅色, 且半分鐘不褪色;③依據得失電子數目守恒,有:n(Fe2+)×1=n(TiO2)×1,即n(TiO2)=n(Fe2+)=24×10-3×0.1mol=2.4×10-3mol,其質量分數為2.4×10-3×80/0.2×100%=96%;


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A. 按系統命名法,![]() 的名稱為2,4,5-三甲基己烷
的名稱為2,4,5-三甲基己烷
B. 3-甲基-3-乙基戊烷的一氯取代產物有6種
C. 化合物![]() 是苯的同系物
是苯的同系物
D. 分子![]() 中,位于同一平面上碳原子最多有6個
中,位于同一平面上碳原子最多有6個
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】目前人類已發現幾千萬種物質,對物質進行分類,有利于我們的學習。下列物質的分類不正確的是
A.SO2(氧化物)B.碘酒(單質)C.HNO3(含氧酸)D.氯水(混合物)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以下6種為中學化學中常見的物質:①Cu、②NaHSO4、③SO3、④H2SO4、⑤CaCO3、⑥Cu(OH)2;其中屬于電解質的是__(填序號)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物J 是我國自主成功研發的一類新藥,它屬于酯類,分子中除苯環外還含有一個五元環。合成J的一種路線如下:
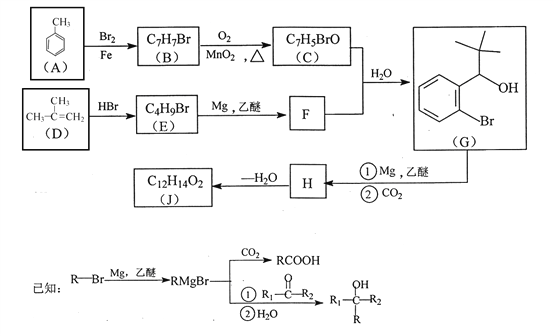
回答下列問題:
(1)B的結構簡式是________________。C的結構簡式是______________。
(2)D生成 E的化學方程式為_________________。
(3)J的結構簡式是________________。在一定條件下,H自身縮聚生成高分子化合物的結構簡式是_______________。
(4)根據![]() ,X的分子式為______。X有多種同分異構體,其中滿足下列條件的同分異構體共有______種(已知:碳碳叁鍵或碳碳雙鍵不能與羥基直接相連)。
,X的分子式為______。X有多種同分異構體,其中滿足下列條件的同分異構體共有______種(已知:碳碳叁鍵或碳碳雙鍵不能與羥基直接相連)。
A.除苯環外無其他環,且無一O—O—鍵
B.能與FeCl3溶液發生顯色反應
C.苯環上一氯代物只有兩種
(5)利用題中信息和所學知識,寫出以甲烷和甲苯 為原料,合成![]() 的路線流程圖(其它試劑自選):____________________________。
的路線流程圖(其它試劑自選):____________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】全球熱播影片《阿凡達》于2010年1月4日在中國內地上映,影片中出現了一種潘多拉星球的宇宙飛船。下表是元素周期表中的一部分,表中所列字母分別表示一種元素。(選項中的物質都由下表中的元素組成)

由以上信息可推斷下列說法正確的是
A. 宇航員在宇宙飛船活動艙內會產生由d和f組成的氣體,吸收這種氣體的化合物應該由e和f組成
B. 活動艙內還要營造一種適合宇航員生存的人工生態環境,即充入a和f的常見單質
C. c和f以原子個數之比為1∶1組成的化合物可用作宇航員所需f單質的來源
D. 若潘多拉星球上存在![]() ,地球上此元素主要以
,地球上此元素主要以![]() 形式存在,
形式存在,![]() 比
比![]() 少一個質子
少一個質子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,重水(D2O)的離子積為1.6×10-15,也可用pH值一樣的定義來規定其酸堿度:pD=-lg[D+],下列有關pD的敘述正確的是( )
①中性D2O的pD=7
②在1LD2O中,溶解0.01molNaOD,其pD值為12
③1L0.01mol/L的DCl的重水溶液,pD=2
④在100mL0.25mol/LDCl的重水溶液中,加入50mL0.2mol/LNaOD的重水溶液,反應后溶液的pD=1.
A. ①②B. ③④C. ②③D. ②④
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com