
【題目】回答下列問題:
(1)基態碳原子的核外電子排布式為______。非金屬元素![]() 的第一電離能大于
的第一電離能大于![]() 的第一電離能,原因是______。
的第一電離能,原因是______。
(2)下表是第三周期部分元素的電離能[單位:[![]() (電子伏特)]數據。
(電子伏特)]數據。
元素 |
|
|
|
甲 | 5.7 | 47.4 | 71.8 |
乙 | 7.7 | 15.1 | 80.3 |
丙 | 13.0 | 23.9 | 40.0 |
丁 | 15.7 | 27.6 | 40.7 |
下列說法正確的是______(填序號)。
A.甲的金屬性比乙強
B.乙有![]() 價
價
C.丙不可能為非金屬元素
D.丁一定為金屬元素
(3)![]() 、
、![]() 均為第四周期過渡金屬元素,兩元素的部分電離能數據列于下表:
均為第四周期過渡金屬元素,兩元素的部分電離能數據列于下表:
元素 |
|
| |
電離能/( | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
錳元素位于第四周期第ⅦB族。請寫出基態![]() 的價電子排布式:______,比較兩元素的I2、I3可知,氣態
的價電子排布式:______,比較兩元素的I2、I3可知,氣態![]() 再失去1個電子比氣態
再失去1個電子比氣態![]() 再失去1個電子難,對此你的解釋是______。
再失去1個電子難,對此你的解釋是______。
(4)鹵族元素![]() 、
、![]() 、
、![]() 、
、![]() 的電負性由小到大的順序是______。
的電負性由小到大的順序是______。
(5)基態![]() 原子的電子排布式為______;
原子的電子排布式為______;![]() 和
和![]() 相比,電負性較大的是______;
相比,電負性較大的是______;![]() 中
中![]() 元素的化合價為______。
元素的化合價為______。
【答案】![]()
![]() 原子的
原子的![]() 軌道達到半充滿狀態,比較穩定 A
軌道達到半充滿狀態,比較穩定 A ![]() 由
由![]() 轉化為
轉化為![]() 時,
時,![]() 能級由較穩定的
能級由較穩定的![]() 半充滿狀態轉變為不穩定的
半充滿狀態轉變為不穩定的![]() 狀態需要的能量較多;而
狀態需要的能量較多;而![]() 轉化為
轉化為![]() 時,
時,![]() 能級由不穩定的
能級由不穩定的![]() 狀態轉變為較穩定的
狀態轉變為較穩定的![]() 半充滿狀態需要的能量相對要少
半充滿狀態需要的能量相對要少 ![]()
![]()
![]()
![]()
【解析】
(1)C的原子序數為6,其基態原子的核外電子排布式為1s22s22p2;O原子和N原子的外圍電子排布式分別為2s22p4和2s22p3,不難看出N原子的2p軌道處于半充滿狀態,比較穩定,故第一電離能較大,故答案為:1s22s22p2;![]() 原子的
原子的![]() 軌道達到半充滿狀態,比較穩定;
軌道達到半充滿狀態,比較穩定;
(2)甲、乙、丙、丁為第三周期元素,甲元素的第一電離能遠遠小于第二電離能,說明甲元素最外層有1個電子,失去1個電子時達到穩定結構,所以甲為Na元素;乙元素的第二電離能遠遠小于第三電離能,則B元素最外層有2個電子,失去兩個電子后達到穩定結構,所以乙為Mg元素;丙、丁元素的第一電離、第二電離能、第三電離能相差不大,說明丙元素最外層大于3個電子,丙可能為非金屬元素,丁一定為非金屬元素;根據上述分析可知,A.甲為Na元素,乙為Mg元素,故甲的金屬性比乙強,故A正確;B.乙為Mg元素,化合價為+2價,故B錯誤;C. 乙為Mg元素;丙、丁元素的第一電離、第二電離能、第三電離能相差不大,說明丙元素最外層大于3個電子,丙可能為非金屬元素,故C錯誤;D. 丙、丁元素的第一電離、第二電離能、第三電離能相差不大,說明丙元素最外層大于3個電子,丁一定為非金屬元素,D錯誤;故選A;
(3)錳元素位于第四周期第ⅦB族,其基態原子的價電子排布式為:3d54s2,則其基態![]() 的價電子排布式:3d5;由
的價電子排布式:3d5;由![]() 轉化為
轉化為![]() 時,
時,![]() 能級由較穩定的
能級由較穩定的![]() 半充滿狀態轉變為不穩定的
半充滿狀態轉變為不穩定的![]() 狀態需要的能量較多;而
狀態需要的能量較多;而![]() 轉化為
轉化為![]() 時,
時,![]() 能級由不穩定的
能級由不穩定的![]() 狀態轉變為較穩定的
狀態轉變為較穩定的![]() 半充滿狀態需要的能量相對要少,故氣態
半充滿狀態需要的能量相對要少,故氣態![]() 再失去1個電子比氣態
再失去1個電子比氣態![]() 再失去1個電子難;
再失去1個電子難;
(4)根據電負性的變化規律可知,鹵族元素![]() 、
、![]() 、
、![]() 、
、![]() 的電負性由小到大的順序是
的電負性由小到大的順序是![]() ;
;
(5)基態![]() 原子的電子排布式為:
原子的電子排布式為:![]() ;同一周期從左至右元素原子的電負性增大,故電負性N>B,B為第二周期ⅢA族元素,其基態原子的電子排布式為:1s22s22p1;BN中N顯-3價,則B顯+3價,故答案為:
;同一周期從左至右元素原子的電負性增大,故電負性N>B,B為第二周期ⅢA族元素,其基態原子的電子排布式為:1s22s22p1;BN中N顯-3價,則B顯+3價,故答案為:![]() ;N;+3。
;N;+3。


 一諾書業暑假作業快樂假期云南美術出版社系列答案
一諾書業暑假作業快樂假期云南美術出版社系列答案科目:高中化學 來源: 題型:
【題目】科學研究證明:核外電子的能量不僅與電子所處的電子層、能級有關,還與核外電子的數目及核電荷數有關。氬原子與硫離子的核外電子排布相同,都是![]() 。下列說法正確的是( )
。下列說法正確的是( )
A.兩粒子的1s能級上電子的能量相同
B.兩粒子的3p能級上的電子離核的距離相同
C.兩粒子的電子發生躍遷時,產生的光譜不同
D.兩粒子最外層都達8電子穩定結構,化學性質相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】阿巴卡韋(Abacavir)是一種核苷類逆轉錄酶抑制劑,存在抗病毒功效。關于其合成中間體 M(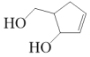 ),下列說法正確的是( )
),下列說法正確的是( )
A.與環戊醇互為同系物B.分子中含有三種官能團
C.能使酸性高錳酸鉀溶液和溴水褪色,且原理相同D.可用碳酸鈉溶液鑒別乙酸和 M
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】溴、銅及其化合物用途非常廣泛。回答下列問題:
(1)基態Br原子核外電子排布式為[Ar]___。
(2)已知反應:Cu(BF4)2.6H2O+Cu+8CH3CN=2[Cu(CH3CN)4]BF4+6H2O。
①配合物[Cu(CH3CN)4]BF4中,與銅形成配位鍵的原子是___,BF4-的空間構型是___,與BF4-互為等電子體的分子有___(任寫一種)。
②CH3CN分子中碳原子的雜化方式是___;1個CH3CN分子中含有___個σ鍵。
(3)電子親合能與電離能相對應,元素的氣態基態原子獲得一個電子成為氣態一價負離子所釋放的能量稱為該元素的第一電子親合能,其大小主要取決于原子的有效核電荷、原子半徑和原子的電子構型等因素。Br與F、Cl位于同一主族,第一電子親合能(如圖1所示)原比氯和溴都小,其原因是___。
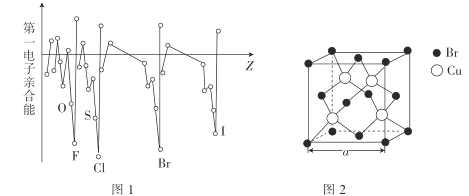
(4)溴化亞銅(晶胞結構如圖2所示)可用作有機合成的催化劑,密度為4.71g·cm-3。
①晶胞中Br-的配位數為___。
②晶胞參數a=___(列出表達式即可)nm。(設NA為阿伏加德羅常數的數值)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室用H2還原SiHCl3(沸點:31.85℃)制備純硅的裝置如圖所示(夾持裝置和尾氣處理裝置略去),下列說法正確的是( )

A. 裝置Ⅱ、Ⅲ中依次盛裝的是濃H2SO4、冰水
B. 實驗時,應先加熱管式爐,再打開盛裝稀硫酸的分液漏斗
C. 為鑒定制得的硅中是否含微量鐵單質,需要用到的試劑為鹽酸、雙氧水、硫氰化鉀溶液
D. 該實驗中制備氫氣的裝置也可用于氧氧化鈉稀溶液與氯化銨固體反應制備氨氣
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在密閉容器中充入5 mol CO和4 mol NO,發生反應: 2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH1=-746.5 kJ/mol,圖1為平衡時NO的體積分數與溫度、壓強的關系。同時為探究催化劑對CO、NO轉化率的影響。將NO和CO以一定的流速通過兩種不同的催化劑進行反應,相同時間內測量逸出氣體中NO含量,從而確定尾氣脫氮率(脫氮率即NO的轉化率),結果如圖2所示。下列說法中正確的是
N2(g)+2CO2(g) ΔH1=-746.5 kJ/mol,圖1為平衡時NO的體積分數與溫度、壓強的關系。同時為探究催化劑對CO、NO轉化率的影響。將NO和CO以一定的流速通過兩種不同的催化劑進行反應,相同時間內測量逸出氣體中NO含量,從而確定尾氣脫氮率(脫氮率即NO的轉化率),結果如圖2所示。下列說法中正確的是
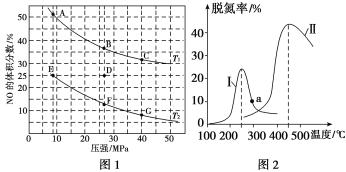
A.溫度:T1<T2
B.若在D點對反應容器降溫的同時縮小體積使體系壓強增大,重新達到的平衡狀態可能是圖中G點
C.E點時NO的平衡轉化率為50%
D.a點是對應溫度下的平衡脫氮率
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是元素周期表的一部分,表中的字母分別代表一種化學元素。

(1)上述元素中,原子中未成對電子數最多的是 ___________ (填字母),寫出該元素基態原子的核外電子排布式: ___________ 。
(2)根據下表所提供的電離能數據,回答下列問題。
鋰 | X | Y | |
I1 | 520 | 496 | 580 |
I2 | 7296 | 4562 | 1820 |
I3 | 11799 | 6912 | 2750 |
I4 | 9543 | 11600 |
①表中X可能為以上13種元素中的 _____________ (填字母)元素。用元素符號表示X和j形成的一種化合物的化學式: _____________ 。
②Y是周期表中第 _____________ 族元素。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.常溫下,HNO2電離反應的平衡常數值為2.6×10-4。NaNO2是一種重要的食品添加劑,由于其外觀及味道都與食鹽非常相似,誤食工業用鹽造成食物中毒的事件時有發生。
(1)某活動小組同學設計實驗方案鑒別 NaCl溶液和NaNO2溶液,請填寫下列表格。
選用藥品 | 實驗現象 | 利用NaNO2的性質 |
①酚酞試液 | ____________ | ____________ |
②淀粉-KI試紙 | ____________ | ____________ |
(2)亞硝酸鈉有毒,不能隨意排放,實驗室一般將其與飽和氯化銨溶液共熱使之轉化成無毒無公害的物質,其產物之一為無色無味氣體,則該氣體為____________(填化學式)。
II.活動小組同學采用如下裝置制備并測定所得固體中亞硝酸鈉(NaNO2)的質量分數(裝置可重復使用,部分夾持儀器已省略)。
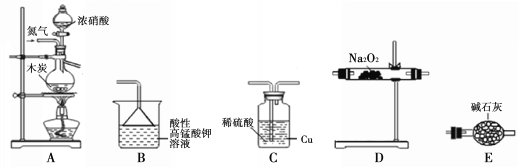
已知: ①2NO + Na2O2 =2NaNO2;
②酸性條件下,NO、NO2都能與MnO4-反應生成NO3-和Mn2+;NaNO2能使
酸性高錳酸鉀溶液褪色。
(1)實驗裝置的連接順序為____________;
(2)C瓶內發生反應的離子方程式為____________。
(3)為了測定亞硝酸鈉的含量,稱取4.0g樣品溶于水配成250mL溶液,取25.00mL溶液于錐形瓶中,用0.10 mol·L-1的酸性KMnO4溶液進行滴定,實驗所得數據如下表。
滴定次數 | 1 | 2 | 3 | 4 |
KMnO4溶液體積/mL | 20.60 | 20.02 | 20.00 | 19.98 |
①第一組實驗數據出現較明顯異常,造成異常的原因可能是__________(填字母序號)。
a.酸式滴定管用蒸餾水洗凈后未用標準液潤洗
b.錐形瓶用蒸餾水洗凈后未干燥
c.觀察滴定終點時仰視讀數
②根據表中數據進行計算,所制得的固體中亞硝酸鈉的質量分數為____________。
(4)設計實驗,比較0.1mol·L-1NaNO2溶液中NO2-的水解程度和0.1mol·L-1HNO2溶液中HNO2電離程度的相對大小_______(簡要說明實驗步驟、現象和結論,儀器和藥品自選)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國是世界上最早制得和使用銅、鋅的國家,銅、鋅及其化合物在日生產和生活中有著廣泛的應用。回答下列問題:
(1)Cu在元素周期表中位于 _____(選填“s” “p” “d”或“ds” )區。在高溫下CuO能分解生成Cu2O,試從原子結構角度解釋其原因______________。
(2)Cu2+能與吡咯(![]() )的陰離子(
)的陰離子(![]() )形成雙吡咯銅。
)形成雙吡咯銅。
①![]() 中C和N原子的雜化均為________,1mol
中C和N原子的雜化均為________,1mol![]() 含有_____molσ鍵。
含有_____molσ鍵。
②雙吡咯銅Cu(![]() )2中含有的化學鍵有_____(填編號)。
)2中含有的化學鍵有_____(填編號)。
A 金屬鍵 B 極性鍵 C 非極性鍵 D 配位鍵 E 氫鍵
③噻吩(![]() )的沸點為84℃,吡咯(
)的沸點為84℃,吡咯( ![]() )的沸點在129 ~131℃之間,吡咯沸點較高,其原因是________。
)的沸點在129 ~131℃之間,吡咯沸點較高,其原因是________。
④分子中的大![]() 鍵可用符號
鍵可用符號![]() 表示,其中m代表參與形成的大
表示,其中m代表參與形成的大![]() 鍵原子數,n 代表參與形成的大
鍵原子數,n 代表參與形成的大![]() 鍵電子數(如苯分子中的大
鍵電子數(如苯分子中的大![]() 鍵可表示為
鍵可表示為![]() ),則
),則![]() 中的大
中的大![]() 鍵應表示為_______。
鍵應表示為_______。
(3)硼氫化鋅[Zn ( BH4 )2 ]常用作有機合成中的還原劑,BH4-的VSEPR模型為______,與其互為等電子體的分子和陽離子有______(各寫一種)。
(4)硒化鋅(ZnSe)是一種半導體材料,其晶胞結構如圖所示,圖中X和Y點所堆積的原子均為______(填元素符號);該晶胞中硒原子所處空隙類型為 _____(填“立方體”、 “正四面體”或“正八面體” ) ;若該晶胞的參數為a pm, NA代表阿伏加德羅常數的數值,則晶胞的密度為_____ gcm-3(用相關字母的代數式表示)。
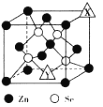
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com