
| A. | 如果V1=V2,c1=c2,則混合溶液中c(CH3COO-)=c(Na+) | |
| B. | 如果混合溶液的pH=7,則混合溶液中c(CH3COO-)=c(Na+) | |
| C. | 如果混合溶液的pH>7,則不可能V1c1=V2c2 | |
| D. | 如果V1=V2,且混合溶液的pH<7,則c1>c2 |
分析 A.根據等體積等濃度混合時醋酸與氫氧化鈉恰好完全反應,則溶液中的溶質只有醋酸鈉,由醋酸根離子的水解來分析;
B.由pH=7,可知c(OH-)=c(H+),再利用電荷守恒來分析;
C.混合溶液的pH>7,利用溶液中的溶質來分析;
D.根據體積相等時若混合溶液的pH<7,則溶液顯酸性,應保證酸過量來分析.
解答 解:A.V1=V2,c1=c2,則醋酸與氫氧化鈉恰好完全反應,反應后溶液中的溶質只有醋酸鈉,由醋酸根離子的水解則c(Na+)>c(CH3COO-),故A錯誤;
B.pH=7,則c(OH-)=c(H+),由電荷守恒c(OH-)+c(CH3COO-)=c(Na+)+c(H+)可知,c(CH3COO-)=c(Na+),故B正確;
C.混合溶液的pH>7,溶液中的溶質可能為醋酸鈉或醋酸鈉與氫氧化鈉的混合物,若為醋酸鈉,則V1c1=V2c2,故C錯誤;
D.V1=V2,且混合溶液的pH<7,則溶液顯酸性,溶液中的溶質為醋酸和醋酸鈉,則c1>c2,故D正確;
故選AC.
點評 本題考查酸堿混合溶液的定性分析和離子的濃度關系,題目難度中等,明確酸堿混合后溶液中的溶質存在三種可能的情況是解答的關鍵,并注意利用弱電解質的電離和鹽的水解來解答.


科目:高中化學 來源: 題型:選擇題
| A. | ${\;}_{8}^{16}$O和${\;}_{8}^{18}$O的質子數相同 | |
| B. | ${\;}_{8}^{16}$O2和${\;}_{8}^{18}$O2互為同素異形體 | |
| C. | ${\;}_{8}^{16}$O和${\;}_{8}^{18}$O中子數相差2 | |
| D. | ${\;}_{8}^{17}$O原子核內中子數與核外電子數之差為1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
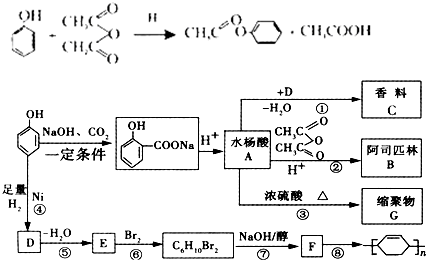
 .
. ;
;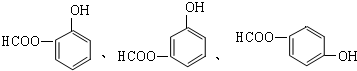 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
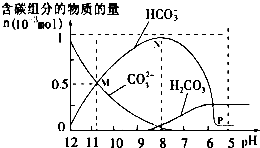 25℃時在10mL 0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液20mL,溶液中部分含碳微粒的物質的量隨溶液pH的變化如圖所示.下列說法不正確的是( )
25℃時在10mL 0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液20mL,溶液中部分含碳微粒的物質的量隨溶液pH的變化如圖所示.下列說法不正確的是( )| A. | HCl溶液滴加一半時,溶液pH>7 | |
| B. | 當溶液的pH=8時,溶液中NaHCO3的物質的量濃度為0.1mol•L-1 | |
| C. | 0.1 mol•L-1Na2CO3溶液中c(Na+)+c(H+)=c(OH-)+2c(CO32-)+c(HCO3-) | |
| D. | 在M點:c(Na+)>c(CO32-)=c(HCO3-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用陶瓷坩堝熔化氫氧化鈉固體 | |
| B. | 用堿式滴定管準確量取15.00mLKMnO4溶液 | |
| C. |  用如圖所示操作排除堿式滴定管中的氣泡 | |
| D. | 用苯萃取溴水中的溴,分液時有機層從分液漏斗的下端放出 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
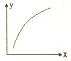 MgO可以通過下列反應制備:MgSO4(s)+CO(g)?MgO(s)+CO2(g)+SO2(g)△H>0,該反應在恒容的密閉容器中達到平衡后,若僅改變圖中橫坐標x的值,重新達到平衡后,縱坐標y隨x的值,重新達到平衡后,縱坐標y隨x變化趨勢合理的是( )
MgO可以通過下列反應制備:MgSO4(s)+CO(g)?MgO(s)+CO2(g)+SO2(g)△H>0,該反應在恒容的密閉容器中達到平衡后,若僅改變圖中橫坐標x的值,重新達到平衡后,縱坐標y隨x的值,重新達到平衡后,縱坐標y隨x變化趨勢合理的是( ) | 選項 | x | y |
| A | CO的物質的量 | CO與CO的物質的量之比 |
| B | SO的濃度 | 平衡常數K |
| C | 溫度 | 容器內混合氣體的密度 |
| D | CO的濃度 | CO的轉化率 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 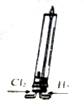 該裝置可模擬工業制取氯化氫 | |
| B. | 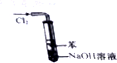 如圖實驗裝置可以處理Cl2尾氣,并防止倒吸 | |
| C. |  如圖實驗制取少量的Fe(OH)3膠體 | |
| D. | 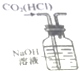 如圖實驗裝置可除去CO2氣體中含有的少量HCl雜質 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com