
【題目】某學生設計了一個“黑筆寫紅字”的趣味實驗。濾紙先用氯化鈉、無色酚酞的混合液浸濕,然后平鋪在一塊鉑片上,接通電源后,用鉛筆在濾紙上寫字,會出現紅色字跡。據此,下列敘述正確的是 ( )
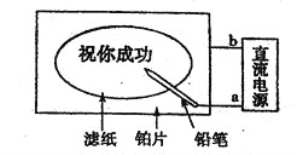
A.鉛筆端作陽極,發生還原反應
B.鉑片端作陰極,發生氧化反應
C.a點是負極,b點是正極
D.鉛筆端有少量的氯氣產生
【答案】C
【解析】
該裝置為電解氯化鈉溶液的實驗裝置,電解時的陰極反應式為:2H++2e-═H2↑或2H2O+2e-═H2↑+2OH-,陽極反應式為:2Cl--2e-═Cl2↑,總反應為:2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑,據此分析解答。
2NaOH+Cl2↑+H2↑,據此分析解答。
A.用鉛筆在濾紙上寫字,會出現紅色字跡,反應為:2H++2e-═H2↑,或2H2O+2e-═H2↑+2OH-,鉛筆書寫過的痕跡附近,溶液的堿性增強,無色酚酞變成紅色,說明鉛筆做陰極,發生還原反應,故A錯誤;
B.陰極發生還原反應,陽極發生氧化反應,在該電解池中,鉛筆做陰極,鉑片做陽極,故B錯誤;
C.用鉛筆在濾紙上寫字,會出現紅色字跡,說明鉛筆接觸處發生2H++2e-═H2↑或2H2O+2e-═H2↑+2OH-,鉛筆做陰極,連接電源的負極,即a為負極,則b為正極,故C正確;
D.用鉛筆在濾紙上寫字,會出現紅色字跡,反應為:2H++2e-═H2↑或2H2O+2e-═H2↑+2OH-,鉛筆做陰極,有氫氣產生,沒有氯氣產生,故D錯誤;
故選C。


科目:高中化學 來源: 題型:
【題目】在一絕熱(不與外界發生熱交換)的恒容容器中,發生反應:2A(g)+B(s)![]() C(g)+D(g),下列描述中不能表明該反應已達到平衡狀態的是
C(g)+D(g),下列描述中不能表明該反應已達到平衡狀態的是
A.混合氣體的密度不變B.單位時間內生成nmolD,同時生成nmolC
C.容器中的溫度不再變化D.C(g)的物質的量濃度不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一固定容積的密閉容器中進行著如下反應:CO2(g)+H2(g)![]() CO(g)+H2O(g),其平衡常數K和溫度t的關系:
CO(g)+H2O(g),其平衡常數K和溫度t的關系:
t℃ | 700 | 800 | 850 | 1000 | 1200 |
K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(1)K的表達式為:_________;
(2)該反應的正反應為_________反應(“吸熱”或“放熱”);
(3)下列選項中可作為該反應在850℃時已經達到化學平衡狀態的標志的是:_________。
A.容器中壓強不再變化 B.混合氣體中CO濃度不再變化
C.混合氣體的密度不再變化 D.c(CO2)=c(CO)=c(H2)=c(H2O)
(4)當溫度為850℃,某時刻測得該溫度下的密閉容器中各物質的物質的量見表:
CO | H2O | CO2 | H2 |
0.5mol | 8.5mol | 2.0mol | 2.0mol |
此時上述的反應中正、逆反應速率的關系式是_________(填代號)。
A.v(正)>v(逆) B.v(正)<v(逆) C.v(正)=v(逆) D.無法判斷
(5)在700℃通過壓縮體積增大氣體壓強,則該反應中H2(g)的轉化率_________(“增大”、“減小”或“不變”);工業生產中,通過此方法使容器內氣體壓強增大以加快反應,卻意外發現H2(g)的轉化率也顯著提高,請你從平衡原理解釋其可能原因是__________________________________________。
Ⅱ.設在容積可變的密閉容器中充入10molN2(g)和10molH2(g),反應在一定條件下達到平衡時,NH3的體積分數為0.25。
(6)求該條件下反應N2(g)+3H2(g)![]() 2NH3(g)的平衡常數__________。(設該條件下,每1mol氣體所占的體積為VL)上述反應的平衡時,再充入10mol的N2,根據計算,平衡應向什么方向移動?[需按格式寫計算過程,否則答案對也不給分]__________。
2NH3(g)的平衡常數__________。(設該條件下,每1mol氣體所占的體積為VL)上述反應的平衡時,再充入10mol的N2,根據計算,平衡應向什么方向移動?[需按格式寫計算過程,否則答案對也不給分]__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某無色混合溶液中可能含有的離子如下表所示:
可能大量含有的陽離子 | H+、Al3+、NH4+、Na+ |
可能大量含有的陰離子 | Cl-、AlO2-、SO42-、MnO4-、Br-、I-、CO32- |
為探究其成分,進行了以下探究實驗。
探究一:
甲同學取一定量的混合溶液,用pH試紙檢驗,溶液pH<7;向其中逐液加入氫氧化鈉溶液,產生沉淀的物質的量(n)與加入氫氧化鈉溶液的體積(V)的關系如圖所示。
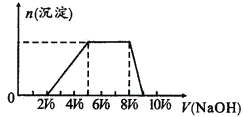
探究二
乙同學取一定量的混合溶液,向溶液中加氯水,無氣體產生,再加入CCl4振蕩、靜置,CCl4層呈橙紅色,用分液漏斗分液;向分液后的水溶液中加入AgNO3和HNO3混合液,有白色沉淀產生。
探究三:
另取原溶液少量加入Ba(NO3)2和鹽酸的混合液,產生白色沉淀。
(1)該溶液中一定含有的陰離子是___;其中能確定離子濃度之比的,對應離子物質的量濃度之比為___;不能肯定是否含有的離子是___。確定其中陽離子的實驗方法為___。
(2)請寫出沉淀減少過程中發生反應的離子方程式___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有A、B、C、D、E、F六種化合物,它們分別由下列五種原子團的兩種不同的基團組成,這五種基團是-CH3,-C6H5,-OH,![]() ,
,![]() 。
。
已知:(1) A是無色晶體,有特殊氣味,在空氣中易氧化成粉紅色;
(2) B、C能發生銀鏡反應,C的分子量大于B;
(3) D的水溶液與少量氫氧化鈉溶液反應,生成-1價的陰離子;與過量氫氧化鈉溶液反應,生成-2價陰離子。D可以和A的鈉鹽反應生成A;
(4) E可以由B氧化制取;
(5) F能氧化成飽和一元醛。
根據上述條件,推斷其結構簡式分別為:
A____________________B_____________________C_______________
D__________________E_____________________F________________。
上述A、D、E的酸性由強到弱的順序是_____________________________(用化學式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有機化合物都有各種官能團,請回答

①可看作醇類的是____________
②可看作酚類的是____________
③可看作羧酸類的是___________
④可看作醛類的是____________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有關物質的轉化關系如下圖所示(部分物質和條件已略去)。A、C是常見的強酸,B是黃色非金屬單質;E是紫紅色金屬單質,G是最常見的無色液體;D、F、I是常見的氣體,D為紅棕色,D與I組成元素相同,且相對分子質量相差16。
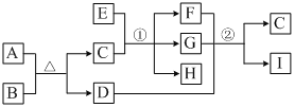
請回答下列問題:
(1)G的化學式為________。
(2)反應①的化學方程式為_____________________________。
(3)E與A的濃溶液反應的離子方程式為_________________________________。
(4)反應②的化學方程式為_____________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗中“實驗內容”與對應“實驗現象和結論”的關系都正確的是( )
選項 | 實驗內容 | 實驗現象和結論 |
A | 向FeCl3+3KSCN | 溶液的血紅色變淺,說明增加生成物濃度,平衡逆移 |
B | 分別往甲:4mL0.1mol·L-1、乙:4mL0.2mol·L-1的酸性KMnO4溶液中加入2mL0.1mol·L-1H2C2O4溶液,記錄褪色時間 | 乙先褪色,說明反應物濃度越大,反應速率越快,越先褪色 |
C | 室溫下,5mL0.1mol·L-1Na2S2O3溶液中加入5mL0.1mol·L-1稀H2SO4溶液,觀察現象 | 溶液立即出現渾濁,說明不可逆反應是瞬間完成的 |
D | 向飽和硼酸溶液中滴加0.1mol·L-1的Na2CO3溶液 | 無明顯現象酸性:H3BO3<H2CO3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是元素周期表的一部分,除標出的元素外,表中的每個編號代表一種元素。請根據要求回答問題:
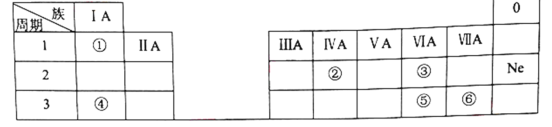
(1)②的元素符號是______。
(2)⑤和⑥兩種元素的非金屬性強弱關系是:⑤______⑥。
(3)①和③兩種元素組成的化合物中含有的化學鍵為________(填“離子鍵”或“共價鍵”)。
(4)④和⑥兩種元素組成的化合物與AgNO3溶液反應的離子方程式為__________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com