
 +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$ +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O +HCl→
+HCl→ +KCl
+KCl
| 序號 | 實驗方案 | 實驗現象 | 結論 |
| ① | 將白色固體B加入水中,溶解 冷卻、過濾, | 得到白色晶體和無色溶液 | -- |
| ② | 取少量濾液于試管中,滴入2-3滴AgNO3溶液 | 生成白色沉淀 | 濾液含有Cl- |
| ③ | 干燥白色晶體,加熱使其融化,測其熔點 | 熔點為122.4℃ | 白色晶體是苯甲酸 |
分析 一定量的甲苯和適量的KMnO4溶液在100℃反應一段時間后停止反應,按如圖流程分離出苯甲酸和回收未反應的甲苯,苯甲酸能溶于水,甲苯不溶于水,互不相溶的液體采用分液方法分離,根據實驗目的知,從而得到有機相和水相,有機相中含有甲苯、水相中含有苯甲酸,有機相中的甲苯采用蒸餾方法得到無色液體A,A是甲苯,將水相鹽酸酸化再蒸發濃縮,根據苯甲酸的溶解度知,得到的固體B是苯甲酸.
(1)分離互不相溶的液體采用分液方法,分離互溶且沸點不同的液體采用蒸餾方法;
(2)甲苯能使酸性高錳酸鉀溶液褪色;
(3)結合反應化學方程式中生成的產物和流程中分離步驟分析,白色固體B是苯甲酸與KCl的混合物;依據苯甲酸熔點122.4℃,在25℃和95℃時溶解度分別為0.3g和6.9g;先檢驗苯甲酸的檢驗再檢驗氯化鉀的存在;
(4)苯甲酸和KOH溶液發生酸堿中和反應,根據苯甲酸和KOH之間的關系式計算苯甲酸的質量,從而計算苯甲酸的質量分數.
解答 解:一定量的甲苯和適量的KMnO4溶液在100℃反應一段時間后停止反應,按如圖流程分離出苯甲酸和回收未反應的甲苯,苯甲酸能溶于水,甲苯不溶于水,互不相溶的液體采用分液方法分離,根據實驗目的知,從而得到有機相和水相,有機相中含有甲苯、水相中含有苯甲酸,有機相中的甲苯采用蒸餾方法得到無色液體A,A是甲苯,將水相鹽酸酸化再蒸發濃縮,根據苯甲酸的溶解度知,得到的固體B是苯甲酸.
(1)分離互不相溶的液體采用分液方法,根據流程圖中,水相和有機相不互溶,可以采用分液方法分離,即操作I為分液,有機相中物質互溶且沸點不同,所以可以采用蒸餾方法分離,即操作II為蒸餾,
故答案為:分液;蒸餾;
(2)通過以上分析知,A是甲苯,甲苯中有甲基,所以能被酸性高錳酸鉀氧化為苯甲酸而使酸性高錳酸鉀溶液褪色,則可以用酸性高錳酸鉀溶液檢驗甲苯,
故答案為:甲苯;酸性KMnO4溶液;溶液褪色;
(3)通過測定白色固體B的熔點,發現其在115℃開始熔化,達到130℃時仍有少量不熔,推測白色固體B是苯甲酸與KCl的混合物,氯化鉀可以用硝酸酸化的硝酸銀溶液檢驗氯離子的存在;利用苯甲酸的溶解度特征在25℃和95℃時溶解度分別為0.3g和6.9g;利用不同溫度下的溶解度,分離混合物,得到晶體后通過測定熔點判斷是否為苯甲酸;
故答案為:
| 序號 | 實驗方案 | 實驗現象 | 結論 |
| ① | 將白色固體B加入水中加熱,溶解,冷卻、過濾 | 得到白色晶體和無色溶液 | -- |
| ② | 取少量濾液于試管中,滴入2-3滴AgNO3溶液 | 生成白色沉淀 | 濾液含有Cl- |
| ③ | 干燥白色晶體,加熱使其融化,測其熔點; | 熔點為122.4℃ | 白色晶體是苯甲酸 |
點評 本題考查了物質性質的實驗分析判斷,物質分離條件,試劑選擇,操作步驟的理解應用,物質成分的實驗設計方案、步驟、試劑,樣品純度的計算,注意答題時從題中獲取有用的信息,題目難度中等.


 世紀百通期末金卷系列答案
世紀百通期末金卷系列答案科目:高中化學 來源: 題型:填空題
| 熔點/℃ | 沸點/℃ | 密度/g•cm-3 | |
| 正丁醇 | -89.53 | 117.25 | 0.81 |
| 1-溴丁烷 | -112.4 | 101.6 | 1.28 |

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 尿素[H2NCONH2]既是一種非常重要的高氮化肥,又是多種有機、無機產品的生產原料.工業上以合成氨廠的NH3和CO2為原料生產尿素.請回答下列問題:
尿素[H2NCONH2]既是一種非常重要的高氮化肥,又是多種有機、無機產品的生產原料.工業上以合成氨廠的NH3和CO2為原料生產尿素.請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 (苯甲醛)+(CH3CO)2O(乙酸酐)$→_{140-170℃}^{K_{2}CO_{3}}$
(苯甲醛)+(CH3CO)2O(乙酸酐)$→_{140-170℃}^{K_{2}CO_{3}}$ (肉桂酸)+CH3COOH(乙酸)
(肉桂酸)+CH3COOH(乙酸)| 名稱 | 分子量 | 性狀 | 密度g/cm3 | 熔點℃ | 沸點℃ | 溶解度:克/100ml溶劑 | ||
| 水 | 醇 | 醚 | ||||||
| 苯甲醛 | 106 | 無色液體 | 1.06 | -26 | 178-179 | 0.3 | 互溶 | 互溶 |
| 乙酸酐 | 102 | 無色液體 | 1.082 | -73 | 138-140 | 12 | 溶 | 不溶 |
| 肉桂酸 | 148 | 無色結晶 | 1.248 | 133-134 | 300 | 0.04 | 24 | 溶 |

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 相對分子質量 | 密度/(g•cm-3) | 沸點/℃ | 水中溶解度 | |
| 異戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙 酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸異戊酯 | 130 | 0.8670 | 142 | 難溶 |

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 實驗序號 | 起始溫度t1/℃ | 終止溫度(t2)℃ | 溫差(t2-t1)℃ | ||
| 鹽酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 分類標準 | 單質 | 氧化物 | 混合物 | 膠體 | 電解質 | 非電解質 |
| 屬于該類的物質 | ② | ④ | ⑧⑨ | ⑦ | ③⑤⑥ | ①④ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
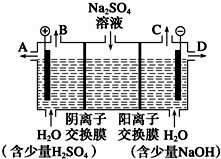 天然礦物芒硝化學式為Na2SO4•10H2O,為無色晶體,易溶于水.該小組同學設想,如果模擬工業上離子交換膜法制燒堿的方法,用如圖所示裝置電解硫酸鈉溶液來制取氫氣、氧氣、硫酸和氫氧化鈉,無論從節省能源還是從提高原料的利用率而言都更加符合綠色化學理念.
天然礦物芒硝化學式為Na2SO4•10H2O,為無色晶體,易溶于水.該小組同學設想,如果模擬工業上離子交換膜法制燒堿的方法,用如圖所示裝置電解硫酸鈉溶液來制取氫氣、氧氣、硫酸和氫氧化鈉,無論從節省能源還是從提高原料的利用率而言都更加符合綠色化學理念.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com