
A.c(H+)·c(OH-)=1×10-14
B.c(H+)+2c(H3XO4)+c(![]() )=c(
)=c(![]() )+c(OH-)
)+c(OH-)
C.c(H+)+c(H3XO4)=c(![]() )+2c(
)+2c(![]() )+c(OH-)
)+c(OH-)
D.c(Na+)+c(H+)=c(![]() )+c(OH-)+2c(
)+c(OH-)+2c(![]() )+3c(
)+3c(![]() )
)
D
【解析】A選項80℃時,水的電離得到促進,所以c(H+)·c(OH)->1×10-14。不正確。B選項c(H+)+2c(H3XO4)+c(![]() )====c(
)====c(![]() )+c(OH-),只是Na2HXO4溶液中“質子守恒”(即水電離產生的H+和水電離產生的OH-的濃度相等)的關系。不正確。C選項c(H+)+c(H3XO4)====c(
)+c(OH-),只是Na2HXO4溶液中“質子守恒”(即水電離產生的H+和水電離產生的OH-的濃度相等)的關系。不正確。C選項c(H+)+c(H3XO4)====c(![]() )+2c(
)+2c(![]() )+c(OH-),只是NaH2XO4溶液中“質子守恒”(即水電離產生的H+和水電離產生的OH-的濃度相等)的關系。不正確。D選項c(Na+)+c(H+)====c(
)+c(OH-),只是NaH2XO4溶液中“質子守恒”(即水電離產生的H+和水電離產生的OH-的濃度相等)的關系。不正確。D選項c(Na+)+c(H+)====c(![]() )+c(OH-)+2c(
)+c(OH-)+2c(![]() )+3c(
)+3c(![]() ),為“電荷守恒”關系,因為兩溶液中的離子組成完全一樣,所以“電荷守恒”關系一樣。正確。
),為“電荷守恒”關系,因為兩溶液中的離子組成完全一樣,所以“電荷守恒”關系一樣。正確。


 階梯計算系列答案
階梯計算系列答案科目:高中化學 來源: 題型:閱讀理解
 研究CO2的利用對促進低碳社會的構建具有重要的意義.
研究CO2的利用對促進低碳社會的構建具有重要的意義.| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
| 容 器 | 甲 | 乙 |
| 反應物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
查看答案和解析>>
科目:高中化學 來源:2011-2012學年河北省衡水中學高二下學期期末考試化學試卷(帶解析) 題型:填空題
(11分)T、X、Y、Z、Q、R、W為周期表前四周期元素,原子序數依次遞增,其中某些元素的相關信息如下表:
| 元素 | 相關信息 |
| T | T原子所處的周期數、族序數分別與其原子序數相等 |
| X | X的基態原子中電子占據三種能量不同的原子軌道,且每種軌道中的電子數相同 |
| Z | Z的基態原子價電子排布為 |
| Q | 在該元素所在周期中,Q的基態原子的第一電離能最小 |
| R | 3p能級上有1個電子 |
| W | W的一種核素的質量數為65,中子數為36 |
查看答案和解析>>
科目:高中化學 來源:2013-2014學年山東省德州市高三模擬檢測(一模)理綜化學試卷(解析版) 題型:填空題
在自來水消毒和工業上砂糖、油脂的漂白與殺菌過程中,亞氯酸鈉(NaClO2)發揮著重要的作用。下圖是生產亞氯酸鈉的工藝流程圖:
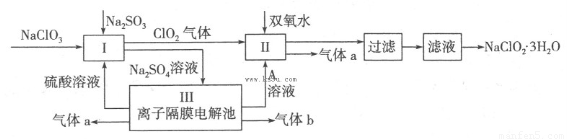
已知:①NaClO2的溶解度隨溫度升高而增大,適當條件下可結晶析出NaClO2·3H2O;
??? ②常溫下,Ksp(FeS)=6.3×10-18;Ksp(CuS)=6.3×10-28;Ksp(PbS)=2.4 ×10-28
(1)反應I中發生反應的離子方程式為?????? 。
(2)從濾液中得到NaClO2·3H2O晶體的所需操作依次是?????? (填寫序號)。
a.蒸餾 ?? b.蒸發濃縮?? c.過濾 ?? d.冷卻結晶??? e.灼燒
(3)印染工業常用亞氯酸鈉(NaClO2)漂白織物,漂白織物時真正起作用的是HClO2。下表是25℃時HClO2及幾種常見弱酸的電離平衡常數:
弱酸 | HClO2 | HF | H2CO3 | H2S |
Ka/mol·L-1 | 1×10-2 | 6.3×10-4 | K1=4.30×10-7 K2=5.60×10-11 | K1=9.1×10-8 K2=l.1×10-12 |
①常溫下,物質的量濃度相等的NaClO2、NaF、NaHCO3、Na2S四種溶液的pH由大到小的順序為??????? (用化學式表示);體積相等,物質的量濃度相同的NaF、NaClO2兩溶液中所含陰陽離子總數的大小關系為:?????????????? (填“前者大”“相等”或“后者大”)。
②Na2S是常用的沉淀劑。某工業污水中含有等濃度的Cu2+、Fe2+、Pb2+離子,滴加Na2S溶液后首先析出的沉淀是???????? ;常溫下,當最后一種離子沉淀完全時(該離子濃度為10-5mol·L-1)此時體系中的S2-的濃度為?????????? 。
(4)Ⅲ裝置中生成氣體a的電極反應式?????????? ,若生成氣體a的體積為1.12L(標準狀況),則轉移電子的物質的量為??? 。
查看答案和解析>>
科目:高中化學 來源:2013屆河北省高二下學期期末考試化學試卷(解析版) 題型:推斷題
(11分)T、X、Y、Z、Q、R、W為周期表前四周期元素,原子序數依次遞增,其中某些元素的相關信息如下表:
|
元素 |
相關信息 |
|
T |
T原子所處的周期數、族序數分別與其原子序數相等 |
|
X |
X的基態原子中電子占據三種能量不同的原子軌道,且每種軌道中的電子數相同 |
|
Z |
Z的基態原子價電子排布為 |
|
Q |
在該元素所在周期中,Q的基態原子的第一電離能最小 |
|
R |
3p能級上有1個電子 |
|
W |
W的一種核素的質量數為65,中子數為36 |
(1)X、Y、Q三種元素的電負性由大到小的順序是 (用元素符號表示)。
(2)X與Y原子結合形成的X3Y4晶體,晶體結構與金剛石類似,則X3Y4晶體的熔點比金剛石要 (填“高”、“低”)。
(3)W2+的核外電子排布式為 。元素W與人體分泌物中的鹽酸以及空氣反應可生成超氧酸:W+HCl+O2=WCl+HO2,HO2 (超氧酸)不僅是一種弱酸而且也是一種自由基,具有極高的活性。下列說法或表示錯誤的是
A.氧化劑是O2 B.HO2在堿中不能穩定存在
C.氧化產物是HO2 D.1 molW參加反應有1 mol電子發生轉移
(4)X、Y、Z分別與氫元素可以構成A、B、C、D等多種粒子。其中A、B、C均為10電子微粒,D為18電子微粒。A為5原子核的+1價陽離子,則A+的中心原子雜化方式為_______. B為4原子核的+1價陽離子,則B+電子式為___________。C為4個原子核構成的分子,則與C互為等電子體的分子可以是_______(寫結構式)。D分子中兩元素的原子個數之比為1:1,則D為 (填“極性”或“非極性”)分子。某雙原子單質分子E也為18電子微粒,E與水的反應的化學方程式為______________________。
(5)已知25℃、101 kPa條件下:
4R(s)+3Z2(g) 2R2Z3(s) △H=-2835.9 kJ/mol
4R(s)+2Z3(g) 2R2Z3(s) △H=-3119.1 kJ/mol
則16g Z2(g)完全轉化為Z3(g)的△H= .
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
T、X、Y、Z、Q、R、W為周期表前四周期元素,原子序數依次遞增,其中某些元素的相關信息如下表:
| 元素 | 相關信息 |
| T | T原子所處的周期數、族序數分別與其原子序數相等 |
| X | X的基態原子中電子占據三種能量不同的原子軌道,且每種軌道中的電子數相同 |
| Z | Z的基態原子價電子排布為 |
| Q | 在該元素所在周期中,Q的基態原子的第一電離能最小 |
| R | 3p能級上有1個電子 |
| W | W的一種核素的質量數為65,中子數為36 |
(1)X、Y、Q三種元素的電負性由大到小的順序是 (用元素符號表示)。
(2)X與Y原子結合形成的X3Y4晶體,晶體結構與金剛石類似,則X3Y4晶體的熔點比金剛石要 (填“高”、“低”)。
(3)W2+的核外電子排布式為 。元素W與人體分泌物中的鹽酸以及空氣反應可生成超氧酸:W+HCl+O2=WCl+HO2,HO2 (超氧酸)不僅是一種弱酸而且也是一種自由基,具有極高的活性。下列說法或表示錯誤的是
A.氧化劑是O2 B.HO2在堿中不能穩定存在
C.氧化產物是HO2 D.1 molW參加反應有1 mol電子發生轉移
(4)X、Y、Z分別與氫元素可以構成A、B、C、D等多種粒子。其中A、B、C均為10電子微粒,D為18電子微粒。A為5原子核的+1價陽離子,則A+的中心原子雜化方式為_______. B為4原子核的+1價陽離子,則B+電子式為___________。C為4個原子核構成的分子,則與C互為等電子體的分子可以是_______(寫結構式)。D分子中兩元素的原子個數之比為1:1,則D為
(填“極性”或“非極性”)分子。某雙原子單質分子E也為18電子微粒,E與水的反應的化學方程式為______________________。
(5)已知25℃、101 kPa條件下:
4R(s)+3Z2(g) 2R2Z3(s) △H=-2835.9 kJ/mol
4R(s)+2Z3(g) 2R2Z3(s) △H=-3119.1 kJ/mol
則16g Z2(g)完全轉化為Z3(g)的△H= .
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com